题目内容
【题目】为测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1 g二氧化锰混合,总质量为6 g,依次加热该混合物,t1、t2、t3、t4时间后分别冷却,称量剩余固体质量,记录的有关数据如下表(样品中杂质不参加化学反应)。
(1)完全反应后产生氧气的总质量为________________。
(2)样品中氯酸钾的纯度是多少___________?
加热时间 | t1 | t2 | t3 | t4 |
剩余固体(g) | 4.24 | 4.16 | 4.08 | 4.08 |
【答案】1.92 g98%。
【解析】
(1)反应前固体总质量为6g,反应后固体质量为4.08g,根据质量守恒定律,生成氧气质量=6g-4.08g=1.92g;
(2)解:假设固体中纯净的氯酸钾质量为x。
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
2×122.5 3×32
x 1.92g
2×122.5/x=3×32/1.92g
解得x=4.9g
因为氯酸钾样品质量为5g,故纯度=(4.9g/5g)×100%=98%
答:样品中氯酸钾的纯度是98% 。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】根据下表回答问题:
温度(℃) | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 100℃ | |
溶解度 (g/100g 水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 246 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 39.8 | |
① 20℃时,50 克水中最多能溶解 NaCl______ g。
② 将硝酸钾的不饱和溶液转化为饱和溶液的方法________。(任写一种方法)若硝酸钾溶液中混有少量氯化钠,可通过______的方法提纯。
③ 硝酸钾和氯化钠溶解度相同的温度范围为______。(填编号)
I. 0℃-10℃ II. 10℃-20℃ III. 20℃-30℃ IV. 30℃-40℃
④ 30℃时,在两个各盛有 100 克水的烧杯中,分别加入相同质量的硝酸钾和氯化钠,充分溶解后,其结果如图所示。

I. 两烧杯中的溶质质量分数大小关系为 A________ B。(填“>”“<”或“=”)
II. 加入的甲物质是________。
III. 对 B 中乙溶液的分析,正确的是______。
a. 加水,溶质质量分数一定变小
b. 一定是该温度下的不饱和溶液
c. 溶解的固体质量一定大于 36.3g,小于 45.8g d. 降温至 10℃,一定有晶体析出
【题目】“分解”与“化合”是两种研究物质组成的方法。
研究问题 | 探究水的元素组成 | 探究氧化汞的元素组成 |
研究方法 | 水的分解 | 汞与氧气的化合 |
搜集证据 |
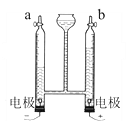
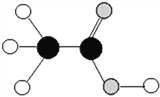
用燃着的木条检验a端气体,气体燃烧发出________色火焰,发生反应的化学方程式为________;用带火星的木条检验b端气体,观察到________。 | 汞与氧气化合的微观过程示意图
请将上图中反应后缺少的微粒补画完整________。 |
结论 | 水是由________元素组成的。 | 氧化汞是由氧、汞元素组成的。 |
【题目】浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔,探究学习小组以含有Ca2+,Mg2+,Cl﹣离子的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1:请回答下列问题: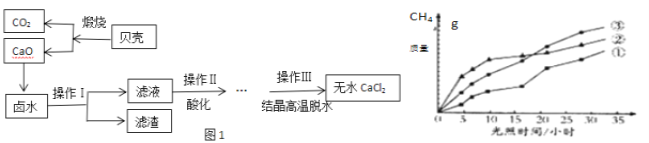
(1)操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒,其中玻璃棒的作用是_______。
(2)以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式_________________。
(3)操作Ⅱ酸化时应选择的酸是______________(填写化学式)。
(4)回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成CH4和O2,该反应的化学方程式为____,紫外线照射时,在不同催化剂(①、②、③)的作用下,CH4产量随光照时间的变化如图所示,在第10小时时CH4产量最高是________(填写“①”、“②”、或“③”).
(5)已知T℃时四种化合物在水中和液氨中的溶解度如下表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O(1) | 170g | 92.0g | 1.50×10﹣4g | 33.3g |
NH3(1) | 86.0g | 97.2g | 0.80g | 0.00g |
上述四种物质能在液氨中发生复分解反应的化学方程式为__________________。