题目内容
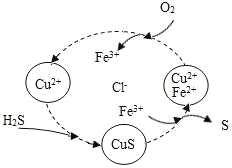
【题目】某种手机电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
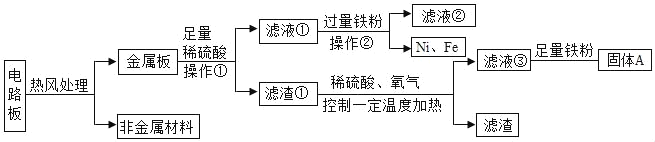
(1)操作①的名称是_____。
(2)写出滤液②中金属阳离子符号_____。
(3)滤渣①中含有的金属_____。
(4)写出滤液①和铁粉发生反应的一个化学方程式_____。
(5)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是_____。
【答案】过滤 Fe2+ Cu、Ag Fe+NiSO4═FeSO4+Ni或Fe+H2SO4═FeSO4+H2↑ Ni、Cu、Ag
【解析】
金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
(1)操作①的名称是过滤,通过过滤能把不溶于水的物质除去。故填:过滤。
(2)操作②后出现镍,说明镍能和稀硫酸反应,铁能和硫酸镍反应,因此滤液②中金属阳离子有稀硫酸和铁反应、铁和硫酸镍反应生成的亚铁离子。故填:Fe2+。
(3)滤渣①中含有的金属是没有反应的铜和银。故填:Cu、Ag。
(4)滤液①和铁粉发生的反应:铁和硫酸镍反应生成硫酸亚铁和镍,和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+NiSO4═FeSO4+Ni,Fe+H2SO4═FeSO4+H2↑。
故填:Fe+NiSO4═FeSO4+Ni或Fe+H2SO4═FeSO4+H2↑。
(5)有以上探究可知,镍能和稀硫酸反应,说明金属活动性顺序中镍排在氢前面,因此Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是Ni、Cu、Ag。故填:Ni、Cu、Ag。

练习册系列答案
相关题目