题目内容
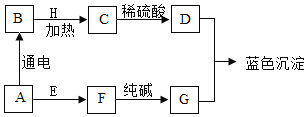
【题目】金属矿物资源有限,所以回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和氯化亚铁溶液,主要流程如下。
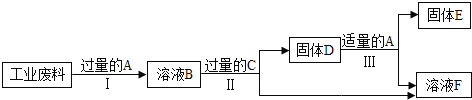
已知:![]()
(1)过程Ⅱ、III充分反应后进行的实验操作是_____。
(2)过程I中氧化铜发生反应的化学方程式是_____。
(3)过程III中加入适量A后现象是_____。
(4)溶液B中含有的阳离子有_____。
(5)若最后得到铜32kg,则原工业废料中含氧化铜的质量是_____ kg。
【答案】过滤 CuO+2HCl=CuCl2+H2O 固体部分减少,有气泡产生,溶液由无色变为浅绿色; H+、Cu2+、Fe3+ 40g
【解析】
(1)过滤能将液体与固体分离。过程Ⅱ、Ⅲ充分反应后,要得到固体和溶液,需要经过过滤操作;
(2)根据流程可知,最终得到氯化亚铁,则溶解氧化铜和氧化铁使用的酸是稀盐酸,氧化铜与盐酸反应生成氯化铜和水,反应的化学方程式为:CuO+2HCl=CuCl2+H2O;
(3)因为过程I加入的盐酸是过量的,所以溶液B中含有盐酸、氯化铜和氯化铁,要得到铜和氯化亚铁,就需要加入过量的铁粉,发生如下反应:铁与盐酸反应生成氯化亚铁和氢气;铁与氯化铜反应生成氯化亚铁和铜;铁与氯化铁反应生成氯化亚铁;反应后得到了固体(剩余的铁粉和生成的铜)和液体(氯化亚铁溶液),要得到纯铜,需要加入盐酸将过量的铁除去;铁会与盐酸反应生成氯化亚铁和氢气,铜不能与盐酸反应,故会观察到固体部分减少,有气泡产生,溶液由无色变为浅绿色;
(4)由(3)分析可知溶液B中含有盐酸、氯化铜和氯化铁,阳离子有氢离子、铜离子、铁离子,它们离子符号分别为:H+、Cu2+、Fe3+;
(4)根据反应CuO+2HCl=CuCl2+H2O,CuCl2+Fe=FeCl2+Cu;;可得转化关系CuO~Cu。
设原工业废料中含氧化铜的质量是x。
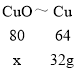
![]() x=40kg。
x=40kg。
答:原工业废料中含氧化铜的质量是40kg。