题目内容
【题目】用Y型管完成下列实验:
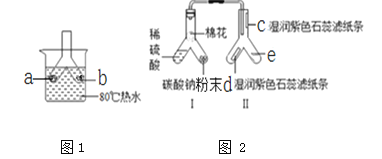
(1)用图1所示装置研究可燃物燃烧的条件。已知:白磷的着火点为40 ℃,红磷的着火点为240 ℃。
①在a处只放白磷,b处只放红磷,Y型管中可以观察到的现象是__________________。反应的化学方程式:__________。
②若要研究可燃物燃烧的另一个条件,在a处放白磷,则应在b处加入_________。
(2)用图2所示装置研究二氧化碳的相关性质。
①已知稀硫酸与碳酸钠的反应与实验室制取二氧化碳反应原理类似,稀硫酸与碳酸钠反应的化学方程式:___________。
②将I的Y型管向右倾斜,使少量的稀硫酸流入碳酸钠中,观察到d处滤纸条先变红,该现象可说明________。
③若要证明②中使紫色石蕊滤纸条变色的物质是H2CO3不是CO2,则应在II的Y型管中应放的用品___________(不改换实验仪器)。
【答案】 a处白磷燃烧,有大量的白烟生成,b处红磷不燃烧 4P+5O2 ![]() 2P2O5 白磷和水,且水没过白磷 Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O 密度比空气大 干燥紫色石蕊滤纸条和湿润的紫色石蕊滤纸条
2P2O5 白磷和水,且水没过白磷 Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O 密度比空气大 干燥紫色石蕊滤纸条和湿润的紫色石蕊滤纸条
【解析】本题考查了依据燃烧的条件及二氧化碳的性质分析解题和设计实验的能力,根据控制变量原理进行分析。
(1)①白磷的着火点为40℃,红磷的着火点为240℃,烧杯内的水是80℃热水,且都与氧气接触,白磷达到着火点,能燃烧,而温度达不到红磷的着火点,红磷不燃烧,所以Y型管中可以观察到的现象是a处白磷燃烧,有大量的白烟生成,b处红磷不燃烧,反应的化学方程式:4P + 5O2 ![]() 2P2O5;
2P2O5;
②可燃物燃烧还须与空气或氧气接触,所以,应在b处加入白磷和水,且水没过白磷与另一侧白磷作对比进行探究;
(2)①稀硫酸与碳酸钠的反应生成硫酸钠和水和二氧化碳,反应的化学方程式为:Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O;
②观察到d处滤纸条先变红,该现象可说明,从而说明二氧化碳的密度比空气大;
③在II的Y型管中放入干燥紫色石蕊滤纸条和湿润的紫色石蕊滤纸条,若干燥紫色石蕊滤纸条不变色,湿润的紫色石蕊滤纸条变红色,则证明②中使紫色石蕊滤纸条变色的物质是H2CO3不是CO2。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案