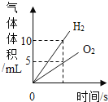
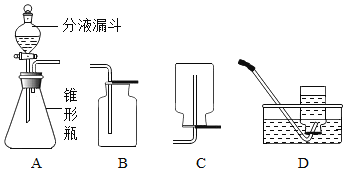
题目内容
【题目】甲醛(HCHO)完全燃烧时生成CO2和H2O;若氧气不充足,甲醛燃烧可能还生成CO。现用以下装置进行实验,确证甲醛燃烧产物中有CO、CO2和H2O。请回答下列问题:
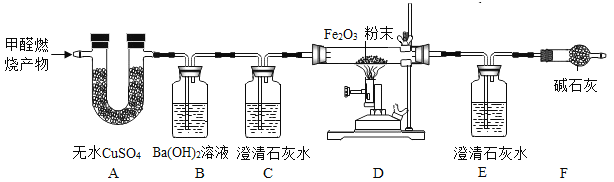
﹝资料卡﹞:①无水CuSO4为白色粉末,遇水可生成蓝色固体;②CO2与足量Ba(OH)2反应生成BaCO3沉淀。
(1)能确证产物中有H2O的现象是_____;
(2)装置B中Ba(OH)2溶液的作用是_____;
(3)实验时,若观察到_____,则证明有CO存在;其中E中发生的化学反应方程式是_______;
(4)该实验装置中有一缺陷之处是_____,改进方案:_____。
(5)若甲醛燃烧产物中CO和CO2的总质量为14.4g,其中碳元素与氧元素的质量比为1:2,则参加化学反应的甲醛的质量为_____;
(6)已知某甲醛溶液中氢元素的质量分数为10%,则其碳元素的质量分数为_____。
【答案】A装置中无水CuSO4由白色变为蓝色 检验并除去CO2气体(仅回答“检验”或“除去”不给分) C中澄清石灰水没有明显变化,D中红色粉末逐渐变黑,E中澄清石灰水变浑浊 ![]() 未进行尾气处理 在F末端点燃一酒精灯或者在F末端用气球将气体收集起来 12g 10%
未进行尾气处理 在F末端点燃一酒精灯或者在F末端用气球将气体收集起来 12g 10%
【解析】
根据水和二氧化碳的检验及其对应的实验现象进行分析解答。
(1)由﹝资料卡﹞:①无水CuSO4为白色粉末,遇水可生成蓝色固体可知能确证产物中有H2O的现象是A装置中无水CuSO4由白色变为蓝色。
(2)Ba(OH)2可与CO2反应生成白色沉淀,故装置B中Ba(OH)2溶液的作用是检验并除去CO2气体。
(3)CO可使Fe2O3发生还原反应,生成铁和二氧化碳,故要证明CO存在,需观察到C中澄清石灰水没有明显变化,D中红色粉末逐渐变黑,E中澄清石灰水变浑浊。E澄清石灰水用来检验二氧化碳,故E中发生的化学反应方程式是![]() 。
。
(4)该实验可能有一氧化碳有毒气体生成,故该实验装置中有一缺陷之处是没有进行尾气处理,改进方案:在F末端点燃一酒精灯或者在F末端用气球将气体收集起来。
(5)因为CO和CO2的总质量为14.4g,且其中碳元素与氧元素的质量比为1:2可知碳元素质量为4.8g,HCHO中C的质量分数为![]() ,故参加化学反应的甲醛的质量为
,故参加化学反应的甲醛的质量为![]() 。
。
(6)甲醛溶液为HCHO和H2O的混合物,观察可写为CH2O与H2O的混合物,其中H与O元素的质量比为固定的且为2:16=1:8,又已知甲醛溶液中氢元素的质量分数为10%,则氧元素质量分数为80%,故碳元素的质量分数为100%-10%-80%=10%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】请回答:如图是元素周期表中的一部分,请回答下列问题.
第一周期 |
|
| ||||||
第二周期 |
|
|
| ① |
|
|
|
|
第三周期 |
|
|
|
|
|
| ② |
|
(1)表中,①所示元素的名称是_______,②所示元素组成的单质的化学式_______;
(2)![]() 与Ne的核外电子排布相同,则X的元素符号为_______,它处在元素周期表中第_______周期,它与氧元素组成的化合物的化学式为_______.
与Ne的核外电子排布相同,则X的元素符号为_______,它处在元素周期表中第_______周期,它与氧元素组成的化合物的化学式为_______.
【题目】某校化学兴趣小组在探究“酸和碱的性质”时,做了如图所示的实验,实验结束后,为了对废液进行处理再排放,需确定反应后溶液中溶质的成分,于是同学们进行了如下探究。请填写空格内容。
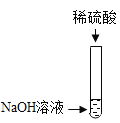
(查阅资料)![]() 溶液呈中性。
溶液呈中性。
(提出猜想)对反应后溶液中的溶质成分做了如下猜想
猜想1:![]() ;
;
猜想2:![]() 和_____;
和_____;
猜想3:![]() 和
和![]() ;
;
猜想4;![]() 、
、![]() 和NaOH
和NaOH
(交流讨论)小强同学认为猜想4一定是错误的,理由是_____。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量反应后的溶液于洁净的试管中,加入锌粒 | _____ | 猜想3正确 |
方案二 | 取少量反应后的溶液于洁净的试管、加入少量氯化钡溶液 | 产生白色沉淀 |
请写出方案一中有关反应的化学方程式_____。
(反思与评价)
(1)小昊同学认为上述方案_____不合理,理由是_____。
(2)分析反应后溶液中溶质的成分,除要考虑生成物外,还需考虑_____。
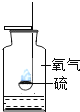
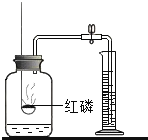
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是![]()
![]()
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水: 吸收有害气体 | 量筒中的水: 通过水体积的变化得出 | 集气瓶中的水: 吸收溅落融熔物 | 集气瓶中的水: 水先将集气瓶内的空气排净,后便于观察 |
A. A B. B C. C D. D