题目内容
 海洋资源十分丰富.
海洋资源十分丰富.(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、
(2)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,
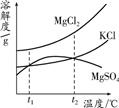
如图是它们的溶解度曲线示意图.设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度大小
关系为
(3)目前世界上60%的镁是从海水中提取的.其主要步骤如下:
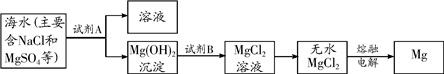
①提取Mg的过程中,试剂B选用
由无水MgCl2制取Mg的化学反应方程式为
在此过程中
②镁是重要的金属材料,广泛应用于合金、火箭和飞机制造业.镁是一种较活泼金属,在二氧化碳气体中也能燃烧.燃烧的化学方程式为:2Mg+C02═C+2MgO,反应类型属于
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为-3.据此写出该反应的化学方程式
| 实验序号 | 第一次实验 | 第二次实验 | 第三次实验 |
| 所取海水质量/kg | 100 | 100 | 100 |
| 生成沉淀质量/kg | 0.28 | 0.29 | 0.30 |
③分离出Mg(OH)2后的NaCl溶液中还含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液和Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了
分析:(1)根据实验室制取粗盐的步骤及操作过程中所用到的仪器分析即可;
(2)根据题干所给图示及溶解度与温度的关系分析即可;
(3)①根据从海水中提取镁的流程和原理分析即可;
②因为沉淀为氢氧化镁,根据沉淀质量可以计算出沉淀中所含镁元素质量,再根据溶质质量分数概念即可计算出海水中镁元素的质量分数;
③根据实验室中除SO4、Ca2+、Ba2+的方法分析即可.
(2)根据题干所给图示及溶解度与温度的关系分析即可;
(3)①根据从海水中提取镁的流程和原理分析即可;
②因为沉淀为氢氧化镁,根据沉淀质量可以计算出沉淀中所含镁元素质量,再根据溶质质量分数概念即可计算出海水中镁元素的质量分数;
③根据实验室中除SO4、Ca2+、Ba2+的方法分析即可.
解答:解:(1)实验室中粗盐经过溶解、过滤、蒸发可制得精盐.该过程所用的主要玻璃仪器有:烧杯、玻璃棒、酒精灯、漏斗.
故答案为:蒸发;酒精灯、漏斗;
(2)根据图示可以看出t1℃时MgCl2、KCl和MgSO4的溶解度大小关系为MgCl2>KCl=MgSO4;
故答案为:MgCl2>KCl=MgSO4
(3)①从海水中提取镁的操作步骤为:向海水中加入过量氢氧化钠溶液,过滤可得到氢氧化镁沉淀,再向沉淀中加入过量盐酸,得到氯化镁溶液,加热蒸发即可得到氯化镁固体,最后电解熔融状态的氯化镁即可得到金属镁.
故答案为:盐酸; MgCl2
Mg+Cl2↑;电能 化学能.
②反应2Mg+C02═C+2MgO,是由一种单质和化合物反应生成了另外一种单质和化合物,所以属于置换反应,选C.
根据题意氮化镁中氮的化合价为-3价,根据化学式的书写规则知氮化镁的化学式为:Mg3N2;
化学方程式为3Mg+N2
Mg3N2;
根据题意可知该沉淀是氢氧化镁沉淀,根据元素守恒可知:100g海水中所含镁元素的质量等于该沉淀所含的镁元素的质量,所以100kg海水中所含的镁元素的质量=0.29×
=0.12kg,
所以100kg海水中含镁元素的质量分数=
×100%=0.12%
故答案为:C;3Mg+N2
Mg3N2;0.12%
③NaCl溶液中含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,依次向混合溶液中加入过量的BaCl2溶液和Na2CO3溶液,
该实验流程为:先向混合溶液中加入过量BaCl2溶液,得到CaCl2、BaSO4沉淀、NaCl、BaCl2的混合物,再向该混合物中加入过量Na2CO3溶液,得到CaCO3沉淀、BaSO4沉淀、NaCl、BaCO3沉淀,过滤即可得到纯净的氯化钠溶液,
故答案为:除去SO42-、除尽Ca2+、Ba2+.
故答案为:蒸发;酒精灯、漏斗;
(2)根据图示可以看出t1℃时MgCl2、KCl和MgSO4的溶解度大小关系为MgCl2>KCl=MgSO4;
故答案为:MgCl2>KCl=MgSO4
(3)①从海水中提取镁的操作步骤为:向海水中加入过量氢氧化钠溶液,过滤可得到氢氧化镁沉淀,再向沉淀中加入过量盐酸,得到氯化镁溶液,加热蒸发即可得到氯化镁固体,最后电解熔融状态的氯化镁即可得到金属镁.
故答案为:盐酸; MgCl2
| ||
②反应2Mg+C02═C+2MgO,是由一种单质和化合物反应生成了另外一种单质和化合物,所以属于置换反应,选C.
根据题意氮化镁中氮的化合价为-3价,根据化学式的书写规则知氮化镁的化学式为:Mg3N2;
化学方程式为3Mg+N2
| ||
根据题意可知该沉淀是氢氧化镁沉淀,根据元素守恒可知:100g海水中所含镁元素的质量等于该沉淀所含的镁元素的质量,所以100kg海水中所含的镁元素的质量=0.29×
| 24 |
| 58 |
所以100kg海水中含镁元素的质量分数=
| 0.12 |
| 100 |
故答案为:C;3Mg+N2
| ||
③NaCl溶液中含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,依次向混合溶液中加入过量的BaCl2溶液和Na2CO3溶液,
该实验流程为:先向混合溶液中加入过量BaCl2溶液,得到CaCl2、BaSO4沉淀、NaCl、BaCl2的混合物,再向该混合物中加入过量Na2CO3溶液,得到CaCO3沉淀、BaSO4沉淀、NaCl、BaCO3沉淀,过滤即可得到纯净的氯化钠溶液,
故答案为:除去SO42-、除尽Ca2+、Ba2+.
点评:本题是相当综合的一道试题,以海水晒盐为知识载体,考查了学生实验仪器的使用、溶解度曲线的应用、溶质质量分数的计算、反应类型、除杂原理等多个中考重点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目



 我国有较长的海岸线,海洋资源十分丰富.
我国有较长的海岸线,海洋资源十分丰富.
