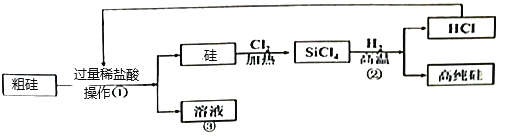
题目内容
【题目】有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
实验一:探究固体的组成
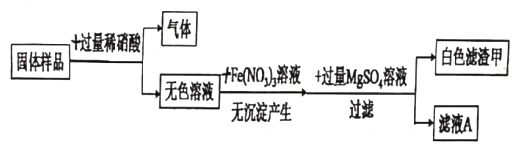
(1)向固体样品中加入过量稀硝酸,产生的气体是_____。
(2)生成白色滤渣甲的反应化学方程式_____。
(3)原固体中一定不含有的物质是_____。
实验二:进一步探究固体中是否含氯化钠
实验操作 | 实验现象 | 实验结论 |
取滤液A少量于试管中,向其中加入_____ | _____ | 原固体中一定含氯化钠 |
【答案】CO2 ![]() 硫酸钠 过量的硝酸钡溶液,过滤,向滤液中滴加硝酸银溶液 产生白色沉淀
硫酸钠 过量的硝酸钡溶液,过滤,向滤液中滴加硝酸银溶液 产生白色沉淀
【解析】
实验一:根据白色固体中加过量的稀硝酸,有无色气体生成可知,原固体中一定有碳酸钠;根据向无色溶液加过量硫酸镁有白色滤渣生成可知,原固体中一定有氢氧化钡,一定没有硫酸钠;然后再根据框图和题干所提供的信息进行分析解答;
实验二:实验过程中要先除去干扰离子,然后再用硝酸银溶液进行检验,根据表格提供的信息进行分析解答。
(1)根据题干所提供的信息可知,向固体样品中加入过量稀硝酸,产生的气体是二氧化碳,故填写:CO2;
(2)通过分析可知,原固体中含有氢氧化钡,氢氧化钡和稀硝酸反应生成硝酸钡,所以白色滤渣甲是硝酸钡和硫酸镁反应生成的硫酸钡,故填写: ![]() ;
;
(3)在原白色固体中加入过量稀硝酸得到无色溶液,通过以上推断可知,原固体中含有氢氧化钡,所以一定不含硫酸钠,故填写:硫酸钠;
实验二:滤液A中含有硫酸镁,硫酸根离子和银离子结合生成微溶于水的硫酸银,会干扰氯离子的检验,所以要向滤液A中加入过量的硝酸钡溶液除去硫酸根离子;向滤液中滴加硝酸银溶液有白色沉淀生成说明原固体中含有氯化钠,故填写:过量的硝酸钡溶液,过滤,向滤液中滴加硝酸银溶液;产生白色沉淀。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】在稀土资源丰富的冷水江,稀土开采工序中使用的草酸、硫酸铵等产生的大量废水严重污染饮用水和农业灌溉用水,已引起了国家的高度重视,
(查阅资料)Ⅰ、草酸的化学式是H2C2O4,草酸是一种无色透明的晶体,无气味,对人体有害,具有酸的通性:如能与碳酸盐作用产生二氧化碳,能与金属反应等。例如:H2C2O4+Na2CO3=Na2C2O4+CO2↑+H2O
Ⅱ、CO遇到浸有磷钼酸溶液的氯化钯黄色试纸,立即变蓝;而CO2遇该试纸不变色。
请你回答下列问题:
写出锌与草酸反应的化学方程式________________。
(实验探究)草酸加热能分解生成水和气体,化学兴趣小组的同学对受热分解生成的气体作如下猜想:
小芳:只有CO2 小兰:只有CO 小红:___________ 小明:有SO2
实验小组的同学对小明的猜想提出了反驳,理由是_____________________________。
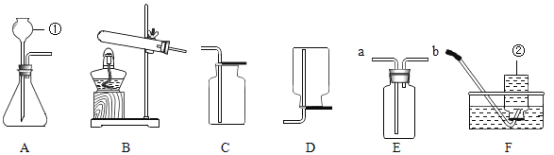
(设计方案)该兴趣小组同学在老师指导下,设计下图所示实验(夹持试管装置省略),通过观察下列装置中的现象,验证猜想。
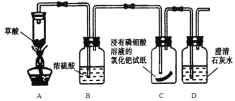
(现象与结论)请你帮助他们完成报告:
步骤 | 现象 | 结论及化学方程式 |
点燃酒精灯加热,观察装置C、装置D中现象 | 装置C中__________ 装置D中澄清石灰水变浑浊 | 小红的猜想正确.装置D中化学方程式为______________________ |
(讨论与反思)实验中依据B装置中___________现象可判断草酸分解生成了水。