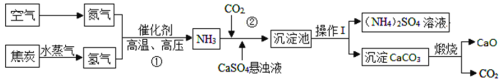
题目内容
【题目】BaCl2是一种重金属盐,其水溶液具有很强的毒性。若误服了BaCl2溶液可立即服用MgSO4溶液解毒。为测定某BaCl2溶液的溶质质量分数,现取 100g 该BaCl2溶液,加入100g MgSO4溶液,两者恰好完全反应,过滤后所得滤液质量为 176.7g。
(1)反应生成沉淀的质量为 g。
(2)原BaCl2溶液中溶质的质量分数。
【答案】(1)23.3;(2)20.8%
【解析】
解:(1)氯化钡和硫酸镁反应生成硫酸钡沉淀和氯化镁,反应前后的质量差即为反应生成沉淀硫酸钡的质量,反应生成沉淀的最大质量为:100g+100g-176.7g=23.3g;
(2)设参加反应的氯化钡质量为![]() ,
,
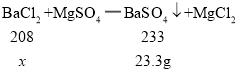
![]()
![]() =20.8g
=20.8g
原BaCl2溶液的溶质质量分数为:![]() ×100%=20.8%。
×100%=20.8%。
答:(1)反应生成沉淀的质量为23.3g。
(2)原BaCl2溶液的溶质质量分数为20.8%。

练习册系列答案
相关题目
【题目】有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
实验一:探究固体的组成
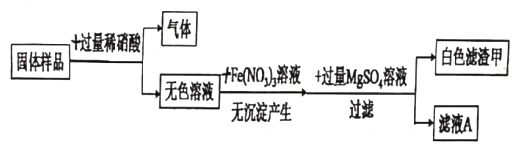
(1)向固体样品中加入过量稀硝酸,产生的气体是_____。
(2)生成白色滤渣甲的反应化学方程式_____。
(3)原固体中一定不含有的物质是_____。
实验二:进一步探究固体中是否含氯化钠
实验操作 | 实验现象 | 实验结论 |
取滤液A少量于试管中,向其中加入_____ | _____ | 原固体中一定含氯化钠 |