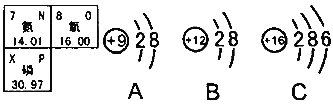
题目内容
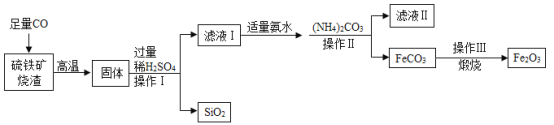
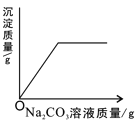
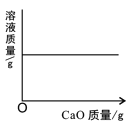
【题目】某同学误将少量 KMnO4当成 MnO2加入 KClO3中进行加热制取氧气,该样品的质量是 260.8g,部分物质质量随时间变化如图所示。
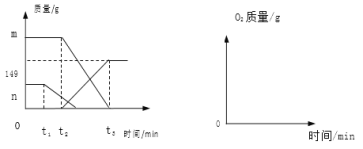
(1)m+n= g
(2)计算该样品中 KClO3的质量分数(写出计算过程,精确到 0.1%)。
(3)在图中,画出反应过程中放出氧气与时间变化的关系图,并进行必要的标注。
【答案】(1) 260.8 (2) 93.9% (详见解析) (3)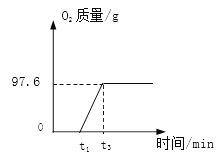
【解析】
高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气。根据图示,质量下降的两种物质分别是锰酸钾和氯酸钾,相同条件下高锰酸钾比氯酸钾容易分解,根据t2>t1,所以m是样品中氯酸钾的质量,n是样品中高锰酸钾质量,因此m+n=260.8g。另一种物质在t2min时质量增多,所以该物质是氯酸钾在二氧化锰催化作用下受热分解生成氯化钾。
解:(1)根据分析,m+n=260.8g;
(2)设样品中氯酸钾质量为![]() ,生成氧气质量为
,生成氧气质量为![]() ,t2min时氯酸钾开始分解,最终生成氯化钾质量是149g,
,t2min时氯酸钾开始分解,最终生成氯化钾质量是149g,
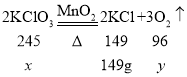
![]()
![]()
![]() = 245g,
= 245g,![]() = 96g
= 96g
样品中 KClO3 的质量分数=![]() ×100%
×100%![]() 93.9%
93.9%
答:样品中 KClO3 的质量分数是 93.9%。
(3)设高锰酸钾分解生成氧气质量为![]() ,
,
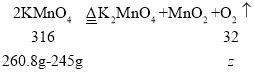
![]()
![]() =1.6g,
=1.6g,
生成氧气总质量:1.6g+96g=97.6g,
反应过程中放出氧气与时间变化的关系图如下所示:


【题目】有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
实验一:探究固体的组成
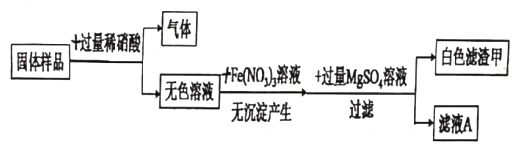
(1)向固体样品中加入过量稀硝酸,产生的气体是_____。
(2)生成白色滤渣甲的反应化学方程式_____。
(3)原固体中一定不含有的物质是_____。
实验二:进一步探究固体中是否含氯化钠
实验操作 | 实验现象 | 实验结论 |
取滤液A少量于试管中,向其中加入_____ | _____ | 原固体中一定含氯化钠 |