题目内容
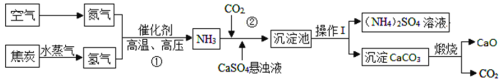
【题目】如图是用粗硅(含CaCO3杂质)制备高纯硅的一种简易流程:
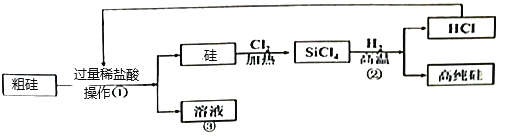
(1)操作①的名称是_____,完成此操作需要的玻璃仪器有烧杯、玻璃棒、_____,该操作中玻璃棒的作用是_____。
(2)粗硅中加入过量稀盐酸的目的是_____。
(3)反应②的化学方程式是_____。
(4)上述生产流程中,可以循环利用的物质是_____(填化学式)。
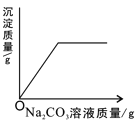
(5)经过滤后得到③的溶液中含有的溶质为:_____、_____。取粗硅样品10g,加入一定质量的稀盐酸,完全反应后,溶液质量增加1.12g,计算该粗硅样品中硅的质量分数_____。
【答案】过滤 漏斗 引流 完全除去碳酸钙 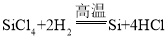 HCl 氯化氢 氯化钙 80%
HCl 氯化氢 氯化钙 80%
【解析】
(1)过滤可以将不溶性固体从溶液中分离出来,所以操作①的名称是:过滤;过滤操作需要用到的仪器有铁架台、烧杯、玻璃棒、漏斗,其中属于玻璃仪器的是:烧杯、玻璃棒、漏斗;该操作中玻璃棒的作用是:引流。
(2)因为碳酸钙能和盐酸反应生成氯化钙、水和二氧化碳,而硅不和盐酸反应,所以粗硅中加入过量稀盐酸的目的是:完全除去碳酸钙。
(3) 反应②是四氯化硅和氢气在高温条件下反应生成硅和氯化氢,化学方程式为: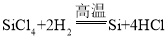 。
。
(4)流程中既是某个反应的反应物,又是某个反应的生成物,这样的物质可以循环使用,因此该流程中可以循环利用的物质是氯化氢,化学式是:HCl。
(5)粗硅中加入的盐酸过量,盐酸和碳酸钙反应生成易溶于水的氯化钙,故经过滤后得到的溶液中含有的溶质为:未反应完的氯化氢和反应生成的氯化钙;
粗硅中加入盐酸,所得溶液质量增加的原因是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,溶液增加的质量等于碳酸钙和二氧化碳的差量,故根据碳酸钙和二氧化碳的差量可以计算出碳酸钙的质量。
设粗硅中碳酸钙的质量为x


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
实验一:探究固体的组成
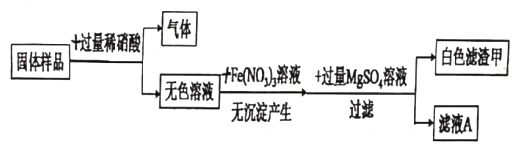
(1)向固体样品中加入过量稀硝酸,产生的气体是_____。
(2)生成白色滤渣甲的反应化学方程式_____。
(3)原固体中一定不含有的物质是_____。
实验二:进一步探究固体中是否含氯化钠
实验操作 | 实验现象 | 实验结论 |
取滤液A少量于试管中,向其中加入_____ | _____ | 原固体中一定含氯化钠 |