题目内容
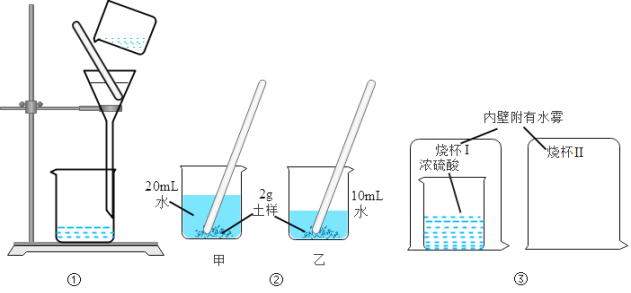
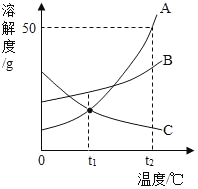
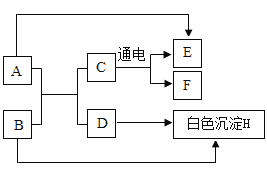
【题目】结合如图所示实验,回答问题:

(1)白色沉淀丙是_____________,无色溶液A的成分为______________(填化学式)。
(2)BaCl2溶液和稀硫酸反应的化学方程式为____________________。
(3)下列说法正确的是___________(填字母)。
A 无色溶液A能使酚酞变蓝
B 无色溶液B可用于金属表面除锈
C 无色溶液C中不可能只有一种溶质
【答案】碳酸钡(![]() )
) ![]()
![]() B
B
【解析】
碳酸钠溶液和氢氧化钡溶液反应得到无色溶液A,则A一定有生成的氢氧化钠,可能有剩余的碳酸钠或者氢氧化钡。氯化钡溶液和稀硫酸反应得到无色溶液B,则B一定有生成的盐酸,可能有剩余的硫酸或者氯化钡。A与B反应有气体产生,则A一定有氢氧化钠、碳酸钠,有碳酸钠就没有氢氧化钡,B中的盐酸和碳酸钠反应放出二氧化碳气体;A与B反应有白色沉淀丙产生,则B中一定有氯化氢、氯化钡,有氯化钡就没有硫酸,A中的碳酸钠与氯化钡反应生成碳酸钡白色沉淀,丙为碳酸钡,碳酸钡能完全溶解于盐酸中。
(1)白色沉淀丙是碳酸钡,无色溶液A的成分为![]() 。
。
(2)BaCl2溶液和稀硫酸反应的化学方程式为![]()
(3)A、无色溶液A中有氢氧化钠和碳酸钠,它们的溶液都呈碱性,能使酚酞变红色,不符合题意;
B、无色溶液B中有盐酸和氯化钡,盐酸可用于金属表面除锈,符合题意;
C、A含有氢氧化钠和碳酸钠,B中含盐酸和氯化钡,如果A与B刚好完全反应,钡离子转化为碳酸钡沉淀,碳酸根离子转化为沉淀和气体,氢氧根离子和氢离子转化成水,那么无色溶液C中就只有一种溶质氯化钠,不符合题意。故选B。

 学而优衔接教材南京大学出版社系列答案
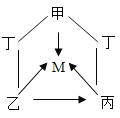
学而优衔接教材南京大学出版社系列答案【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。
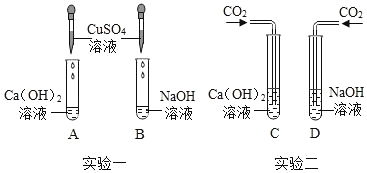
(1)实验一中,A、B 两支试管中共同的实验现象是__________________,其中B试管内发生反应的化学方程式为__________________。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是___________(填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
[提出猜想]猜想1:溶质是NaOH;猜想2:溶质是NaOH和Na2CO3;猜想3:溶质是Na2CO3。
[实验验证]
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中,加入过量稀盐酸 | _______________ | 猜想1不成立 |
②取D中少量溶液于试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
[反思与评价]
(1)小军评价实验操作②中加入Ca( OH)2溶液不正确,理由是__________________。
(2)实验室中氢氧化钠要密封保存的原因是____________________。