题目内容
【题目】工业上制取烧碱的方法之一是电解食盐水法,在生成烧碱的同时还在两电极上产生两种气体(经检验均不是氧气),则该反应的化学方程式为________________________________。
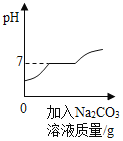
某化学小组在化工商店购得某品牌的烧碱样品,准备用于化学实验。当将其配制成溶液时,小刚同学观察包装袋标签发现了问题:根据生产日期,这包烧碱存放时间较长,会不会变质呢?于是对这包烧碱进行如下探究:
(一)这包烧碱含有什么成分?
(1)打开后发现样品表面出现一层白色粉末,初步判断已经变质出现该现象的原因是_______________(用化学方程式表示);
(2)小刚同学猜想:该包烧碱的成分可能是NaOH和Na2CO3、也可能完全是Na2CO3;
(3)实验探究:
实验操作 | 现象 | 结论 |
①取少量样品于试管中.完全溶于水,加足量BaCl2溶液 | 产生白色沉淀 | 含有Na2CO3 |
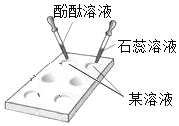
②取①中上层清液,滴加____________试液 | __________________ | 还含有NaOH |
反思1:小红同学在实验完成后提出个人质疑:化学反应中的原料往往不能完全转化为产品,所以电解食盐水法制得的烧碱中往往会含有_____________杂质(填化学式)。所以需要进行再探究;
另取上述实验①中的上层清液,滴加足量稀硝酸和AgNO3溶液,产生白色沉淀,得出结论,说明小红的质疑是正确的。
反思2:小亮认为,小红的实验设计有缺陷,要想证明其结论是正确的.需要对上述实验探究作一改进后,才能得出小红质疑是正确的结论。改进的方法是____________________________。
(二)成分含量测定
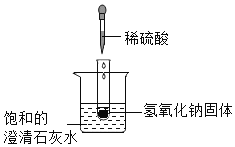
a.取样品mg放入如图装置中加水完全溶解,后放在电子天平上称量为m1g;
b.打开分液漏斗活塞加入足量稀硝酸溶液,待反应停止再称量为m2g;
c.逐滴向上述反应后容器中加入M溶液至不再产生沉淀;
d.将上述混合物过滤、洗涤、烘干,称得沉淀质量为m3g。
e计算样品中Na2CO3的质量分数= ![]()
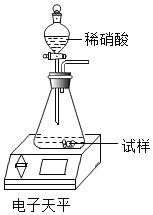
试完成下列问题:
(1)M是________________溶液(填化学式);
(2)利用沉淀物的质量(m3g)计算样品中氯化钠的质量分数,若沉淀未洗涤,则氯化钠的质量分数将_______(选填“偏大”“偏小”或“没影响”)。
【答案】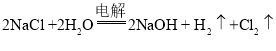
![]() 酚酞(或CuSO4) 溶液变红(或产生蓝色沉淀) NaCl 将实验①所用BaCl2溶液改为Ba (NO3)2溶液.再取实验①上层清液进行再探究 AgNO3 偏大
酚酞(或CuSO4) 溶液变红(或产生蓝色沉淀) NaCl 将实验①所用BaCl2溶液改为Ba (NO3)2溶液.再取实验①上层清液进行再探究 AgNO3 偏大
【解析】
业上制取烧碱的方法之一是电解食盐水法,氯化钠溶液通电产生氢氧化钠、氢气和氯气的化学方程式: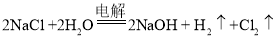 。
。
(一) (1)打开后发现样品表面出现一层白色粉末,初步判断已经变质出现该现象的原因是氢氧化钠与二氧化碳反应产生碳酸钠和水:![]() ;
;
(3)实验探究:
实验操作:①取少量样品于试管中.完全溶于水,加足量氯化钡溶液,因为碳酸钠能与氯化钡反应产生碳酸钡沉淀和氯化钠(显中性),若产生白色沉淀,说明含有碳酸钠;
②取①中上层清液,滴加酚酞试液,若溶液变红,说明溶液显碱性,含有氢氧化钠;
反思1:小红同学在实验完成后提出个人质疑:化学反应中的原料往往不能完全转化为产品,所以电解食盐水法制得的烧碱中往往会含有氯化钠(NaCl)杂质。
反思2:小亮认为,小红的实验设计有缺陷,要想证明其结论是正确的.需要对上述实验探究作一改进后,才能得出小红质疑是正确的结论。改进的方法是:将实验①所用BaCl2溶液改为Ba (NO3)2溶液,(排除氯离子对实验的干扰,因为氯离子能与硝酸银反应产生氯化银白色沉淀)再取实验①上层清液进行再探究。
(二)成分含量测定
(1)M是硝酸银(AgNO3)溶液,硝酸银能与氯离子反应产生氯化银白色沉淀;
(2)利用沉淀物的质量(m3g)计算样品中氯化钠的质量分数,若沉淀未洗涤,则白色沉淀表面粘有硝酸钠溶液,烘干后,白色沉淀质量偏大,导致氯化钠的质量分数将偏大。

【题目】已知废旧干电池填料中含有二氧化锰、氯化铵和氯化锌等,某化学兴趣小组想回收利用废旧干电池中的二氧化锰和氯化铵,设计了如下流程:

(1)操作1和操作2的名称都是_____,该操作中用到的玻璃仪器除漏斗、烧杯外,还需要_____,其作用是_____。
(2)灼烧滤渣l时,会产生一种使澄清石灰水变浑浊的气体,由此推测滤渣1中除含有MnO2外,还存在的物质是_____。
(3)己知滤液1中氯化铵和氯化锌的浓度相近.在某温度下蒸发滤液1时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度_____氯化锌的溶解度(填“<”、“=”或“>”)。
(4)同学们还设计了下列实验探究滤液2中的溶质成分。
(猜想)猜想一:氯化锌 猜想二:_____ 猜想三:氯化锌和氯化铵
(查阅资料)在氯化锌溶液中逐滴滴入稀氨水,先会生成白色沉淀,继续滴加白色沉淀会溶解。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液2,加入到过量氢氧化钠溶液中,并加热 | _____ | 滤液2中含有氯化铵 |
另取少量滤液2,_____ | _____ | 滤液2中含有氯化锌 |
(结论)猜想三成立。
【题目】某同学为测定某大理石中碳酸钙的质量分数(大理石中的杂质不与盐酸反应),取四份样品分别加入稀盐酸反应,其实验数据记录如下:
样品 | 第一份 | 第二份 | 第三份 | 第四份 |
取样品质量 | 10 | 10 | 10 | 10 |
取稀盐酸的质量 | 25 | 50 | 75 | 100 |
产生气体质量 | 1.1 | m | 3.3 | 3.3 |
(1)表格中的m= g。
(2)测定前先将大理石捣碎的目的是 。
(3)该大理石中碳酸钙的质量分数是多少?