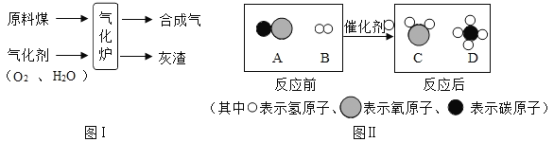
题目内容
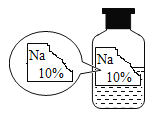
【题目】实验室有一瓶标签损坏并且没有完全密封的溶液(如图),可能是NaCI、NaOH、Na2CO3、NaHCO3中的一种,为确定其成分,同学们进行了如下探究活动。
[查阅资料]常温下,有关物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/100g水 | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为________。
[进行实验]
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是________。
(2)同学们另取样品又进行了如下实验:
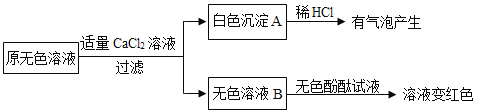
①生成白色沉淀A的化学方程式为_________。
②通过实验可以判断无色溶液样品中含有的溶质有________。
[获得结论]实验完成后,最终得到的结论:瓶中原溶液的溶质是________。
【答案】碳酸氢钠的饱和溶液溶质质量分数在该温度下不能达到10% 氯化钠 ![]() Na2CO3 NaOH NaOH
Na2CO3 NaOH NaOH
【解析】
查阅资料:从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为原溶液的浓度为10%,碳酸氢钠在常温下的溶解度为9.6g,该温度下,饱和碳酸氢钠溶液中溶质的质量分数为:![]() ,故该温度下,碳酸氢钠的溶质质量分数达不到10%,原溶液的溶质一定不是NaHCO3。
,故该温度下,碳酸氢钠的溶质质量分数达不到10%,原溶液的溶质一定不是NaHCO3。
进行实验:(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是氯化钠,因为氯化钠的pH=7;
(2)①向原无色溶液中,加入过量的氯化钙溶液,有白色沉淀A生成,向白色沉淀A中加入稀盐酸,有气泡产生,则原溶液中含有碳酸钠,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,该反应的化学方程式为:![]() ;
;
②向无色溶液B中加入无色酚酞试液,溶液变红,说明溶液显碱性,由于加入了过量的氯化钙,氯化钙已经将溶液中的碳酸钠完全除尽,则溶液含有氢氧化钠,故通过实验可以判断无色溶液样品中含有的溶质有Na2CO3 NaOH;
获得结论:瓶中原溶液的溶质是氢氧化钠,由于没有密封保存,氢氧化钠和空气中的二氧化碳反应生成了碳酸钠。

 名校课堂系列答案
名校课堂系列答案