题目内容
【题目】炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
![]()
(1)写出②反应的化学方程式________;
(2)③发生还原反应的物质是__;
(3)反应完全结束后,检验所得固体中含有铁的最简单方法是________。
【答案】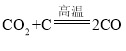 (不写条件扣1分) Fe2O3(氧化铁或三氧化二铁) 用磁铁吸引
(不写条件扣1分) Fe2O3(氧化铁或三氧化二铁) 用磁铁吸引
【解析】
(1)二氧化碳与碳在高温的条件下反应生成一氧化碳;故填:CO2+C![]() 2CO;
2CO;
(2)高温条件下,一氧化碳还原氧化铁生成铁和二氧化碳,化学方程式是3CO+Fe2O3![]() 3CO2+2Fe;该反应中氧化铁提供氧,是氧化剂,发生还原反应;一氧化碳夺取氧化铁中的氧,为该反应中的还原剂,具有还原性。故填:Fe2O3;
3CO2+2Fe;该反应中氧化铁提供氧,是氧化剂,发生还原反应;一氧化碳夺取氧化铁中的氧,为该反应中的还原剂,具有还原性。故填:Fe2O3;
(3)铁可以被磁铁吸引,所以检验所得固体中含有铁的最简单方法是用磁铁吸引;故填:用磁铁吸引。

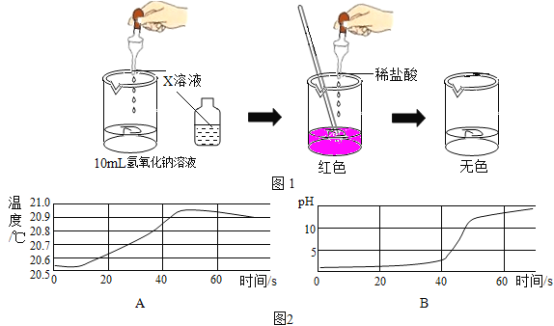
【题目】实验室有一瓶标签损坏并且没有完全密封的溶液(如图),可能是NaCI、NaOH、Na2CO3、NaHCO3中的一种,为确定其成分,同学们进行了如下探究活动。
[查阅资料]常温下,有关物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/100g水 | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为________。
[进行实验]
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是________。
(2)同学们另取样品又进行了如下实验:
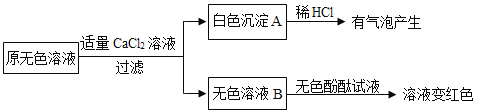
①生成白色沉淀A的化学方程式为_________。
②通过实验可以判断无色溶液样品中含有的溶质有________。
[获得结论]实验完成后,最终得到的结论:瓶中原溶液的溶质是________。
【题目】一次化学兴趣小组活动中,老师拿来一瓶标签有破损的试剂瓶,如下图,里面盛有一种无色溶液。该化学兴趣小组的同学对此展开探究:
(提出问题)这瓶无色溶液的溶质是什么呢?
(作出猜想)猜想一:CaCO3;
猜想二:CaCl2;
猜想三:Ca(OH)2;
猜想四:Ca(NO3)2。
(讨论交流)讨论后,大家一致认为猜想一是错误的,其理由是________。
(查阅资料)CaCl2溶液、Ca(NO3)2溶液均呈中性。
(实验探究)为验证其余猜想,小组的四位同学分别设计了如下实验:
实验编号 | 实验一 | 实验二 | 实验三 | 实验四 |
实验方案 |
|
|
|
|
实验现象 | 产生白色沉淀 | 产生白色沉淀 | 产生红褐色沉淀 |
(得出结论)猜想三成立,此无色溶液为Ca(OH)2溶液。
(表达交流)(1)实验一的现象是_________。
(2)实验二的化学反应方程式为___________。
(3)小组同学经过讨论,一致认为实验三不能证明猜想三成立,其理由是__________。
(拓展迁移)(1)实验四中的X溶液可以是_______(填化学式)溶液。
(2)取用化学试剂时为防止标签受损,倾倒液体时应________。
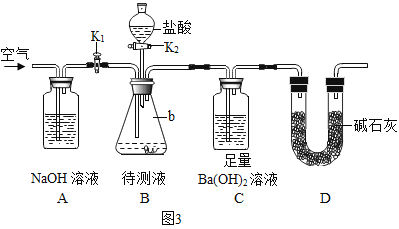
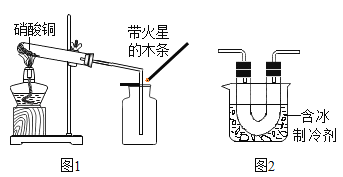
【题目】加热硝酸铜[Cu(NO3)2]可以制取氧化铜。用图1装置加热蓝色硝酸铜固体。发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
[提出问题]硝酸铜加热生成什么气体?
[查阅资料]①含氮化合物中,只有二氧化氮是红棕色、有刺激性气味的气体
②二氧化氮密度大于空气,具有助燃性,…………
[猜想假设]猜想一:生成气体是(填写化学式)________________。
猜想二:生成气体是二氧化氮和氧气
[进行实验]在图1的试管和集气瓶之间连接图2所示装置,重新加热硝酸铜;
[实验现象]________________。
[实验结论]猜想二正确:写出有关化学反应文字表达式:________________。
[反思与评价](1)根据图2装置补充参阅资料②中“………..”NO2的性质是________________。
(2)化学反应前后原子个数不变,经计算生成二氧化氮与氧气的分子个数比为4:1;已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料②,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出二氧化氮可能具有助燃性。理由是________________。
[实验延伸]取制取的氧化铜0.2g,加入5mL5%的双氧水中,发现立即产生大量气泡,带火星木条复燃;氧化铜是否为反应催化剂?请补充实验证明。
实验操作 | 实验现象 | 实验结论 |
_______________ | __________________ | 氧化铜在反应前后质量化学性质不变,是双氧水制取氧气的催化剂。 |
________________ | _________________ |