��Ŀ����
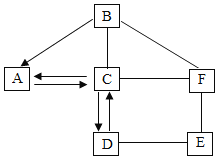
����Ŀ����ˮɹ�ο��Ƶô��Σ����γ��Ȼ����⣬������MgCl2��CaCl2��Na2SO4�Լ���ɳ�����ʣ�������ij��ѧ��ȤС���ƶ���һ���Ʊ����ε�ʵ�鷽����������ͼ��ʾ��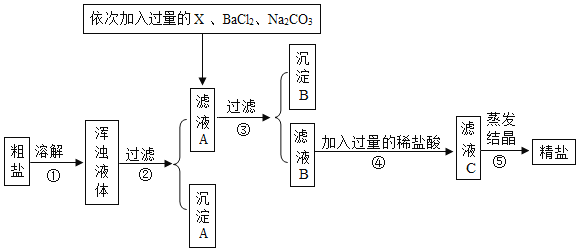
���������ϣ������Ա����о綾�����Ե��µ����ʱ��ԣ��ƻ����ڸ���ø��ʹһϵ����������ƻ���
������������1��������в�������������______________���ܽ����ʱ����ˮ���������˹��࣬Ҳ���˹��٣���������____________________________�����ٻ�ʹ�þ��εIJ���__________������ƫ��������ƫ��������
��2�������Լ�X����Ҫ�����___________��ѡ����ĸ��
A�������� B������������Һ C������������Һ D������������Һ E������������Һ
��3���Ȼ�����Һ��̼������Һ������˳��__________�����������������������ߵ�������B�еijɷ���BaSO4��CaCO3�ͣ��ѧʽ��_____________________��
��4��ijͬѧΪ��֤����ҺC�Ƿ�������ʣ�࣬��Ƶ����з�������ȷ����________��ѡ����ĸ����
A��ȡ��������ͭ����������˵������û��ʣ��
B��ȡ��������ҺpH����pH��7��˵��������ʣ��
C��ȡ������̼������Һ���������ݲ�����˵��������ʣ��
D��ȡ��������������Һ�����а�ɫ����������˵��������ʣ��
����˼�����ۣ���5��С��ͬѧ��Ϊ�÷���ʵ�ʵõ����Ȼ��Ʊ�ԭ�����к��е��Ȼ���Ҫ�࣬����Ϊ���ҳ�����____________��
���𰸡��ӿ��ܽ���������ʱ�˷�ȼ�ϲ��Һ�ʱ��ƫ��ABCD���ܡ���BaCO3��Mg��OH��2BC��Ӧ�������Ȼ���
��������
(1)������в������������Ǽ����ܽ⣻�ܽ����ʱ����ˮ���������˹��࣬Ҳ���˹��٣�������������ʱ�˷�ȼ�ϲ��Һ�ʱ�����ܽ����ʱ������ˮ���������٣��ᵼ���Ȼ��Ʋ�����ȫ�ܽ⣬�Ӷ���ʹ�ô��εIJ���ƫ�ͣ�
(2)A���������ܺ�ˮ��Ӧ�����������ƣ����������ܺ��Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ���������Ʒ���Ҫ��B�����������ܺ��Ȼ�þ��Ӧ����������þ�������Ȼ�������������Ʒ���Ҫ��C�����������ܺ��Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ���������Ʒ���Ҫ��D�����������ܺ��Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ���������Ʒ���Ҫ��E���������غ��Ȼ�þ��Ӧ����������þ�������Ȼ��أ��Ȼ������Ժ����в��ܳ�ȥ������������ز�����Ҫ����
(3)�Ȼ�����Һ��̼������Һ������˳���ܵߵ���������Ϊ����ߵ�����˵��Ȼ������ܳ�ȥ������B�еijɷ���BaSO4�ͷ�Ӧ���ɵ�CaCO3��BaCO3��Mg(OH)2��
(4)A��ͭ�������Ӧ��û������������˵������ʣ�࣬�ʴ���B���Ȼ�����Һ�����ԣ�pH=7�����������ԣ�pH��7��˵��������ʣ�࣬����ȷ��C��ϡ�����Na2CO3��Ӧ���ɶ�����̼�������ݲ�����˵���������������ȷ��D���Ȼ��ƺ����ᷴӦҲ�����Ȼ�����ɫ��������˵������������ʴ�����
(5)С��ͬѧ��Ϊ�÷���ʵ�ʵõ����Ȼ��Ʊ�ԭ�����к��е��Ȼ���Ҫ�࣬����Ϊ���ᴿ�����з�Ӧ�������Ȼ��ơ�

����Ŀ����һ�������£���һ���ܱ������ڷ���ij��Ӧ����÷�Ӧ�����и����ʵ����������ʾ������˵������ȷ���ǣ�������
���� | X | Y | Z | W |
��Ӧǰ����/g | 10 | 3 | 90 | 0 |
��Ӧ������/g | 3.2 | 3 | ���� | 3.2 |
A. W�����ǵ��� B. Y�����Ǵ���
C. �÷�Ӧ�ǷֽⷴӦ D. ��Ӧ��Z���ʵ�����Ϊ![]()