题目内容
【题目】碱式氯化镁【Mg(OH)Cl】受热能分解,它分解后产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl2、MgO、HCl气体、H2O、Cl2。
老师告诉他产物就是上述猪想中的其中几种,并提示Cl2是一种黄绿色有刺激性气味的气体。
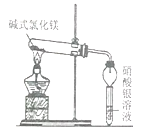
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验。加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有_______气体,无其他气体。
【实验二】取少量实验一的剩刹余固体于试管中,加入足量稀盐酸,没有气泡产生。由此推知Mg(OH)Cl分解后产物中没有_______。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO3溶液,无沉淀产生。由此推知Mg(OH)Cl分解后产物中没有________。
【结论】Mg(OH)Cl受热分解的化学反应方程式为____________。
【答案】【实验一】HCl 【实验二】Mg 【实验三】MgCl2
【结论】Mg(OH)Cl![]() MgO+HCl↑
MgO+HCl↑
【解析】【实验一】管内无黄绿色气体,说明没有生成氯气;大试管口也没有液滴形成,说明没有生成水;硝酸银溶液中有白色沉淀产生,说明生成了HCl气体,HCl气体溶于水形成盐酸,盐酸与硝酸银反应生成氯化银沉淀;【实验二】镁能与稀盐酸反应生成氢气,猜想中的其他物质不能。现取少量实验一的剩刹余固体于试管中,加入足量稀盐酸,没有气泡产生,说明Mg(OH)Cl分解后产物中没有金属镁;【实验三】氯化镁能与硝酸银反应生成氯化银沉淀。现加入足量稀硝酸,固体全部溶解,再滴入AgNO3溶液,无沉淀产生,说明没有生成氯化银沉淀,即没有氯化镁,那么一定含有氧化镁;【结论】结合实验一、二、三可知Mg(OH)Cl 分解生成了氧化镁和氯化氢气体,故反应的化学方程式表示为:Mg(OH)Cl![]() MgO+HCl↑。
MgO+HCl↑。