��Ŀ����
����Ŀ��ij��ѧ��ȤС���ͬѧ����������ʯ��ϡ������ȡ������̼��ʵ��������Ӧ����ƿ�в����ķ�Һ���ˣ�������Һ����̽��(��֪����ʯ���������ʼȲ�����ˮ��Ҳ�����ᷴӦ)��
(�������)��Һ������������ʲô��
(��������)�Ȼ�����Һ������
(���������)
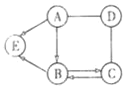
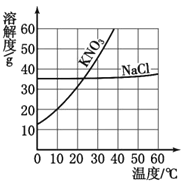
����1�����ʿ�����CaCl2��CaCO3������2������ֻ��CaCl2������3��������____��
(�����뽻��)
С����Ϊ����1������֤��֪���Ǵ���ģ�����������_____��
(ʵ�������)
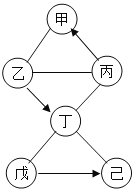
(1)С��ͬѧΪ��֤����2��ȡ������Һװ���Թ��У�Ȼ������̪��Һ�����ַ�̪��Һ����ɫ������С����Ϊ����2��ȷ������Ϊ���Ľ���___(������ȷ������������)��������___��
(2)С��Ϊ��֤����3���ýྻ����IJ�����պȡ����Һ�ε�ʪ���pH��ֽ�ϣ����pH=4������Ϊ����3��ȷ�������IJ���������������������۵����ۣ���ȷ����____��
A ��������ȷ�����ƫС��������ȷ B ������ȷ�����ƫ���۲���ȷ
C ��������ȷ�����ƫ������ȷ D ������ȷ�����ƫС�����۲���ȷ
(3)С��ʹ���˼����������ͬ����������֤����3��Ҳ�ó��˽��ۣ�������±���
���� | ʹ�õ��Լ� | ʵ������ | ���� |
A | ʯ����Һ | ��Һ��� | ����3��ȷ |
B | þ�� | �����ݲ��� | |
C | ____ | �����ܽ⣬��Һ�����ɫ | |
D | ��������Һ | ������ɫ���� |
(��˼������)���������д������ԭ����_____(��д��������ţ�������������ԭ��)��
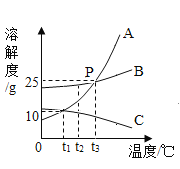
(4)С��ͬѧ��һ����������������3��Һ����μ���������������Ϊ10.0%��Na2CO3��Һ����Ӧ�����м����Na2CO3��Һ����������������������������ϵ��ͼ��ʾ���ʣ�
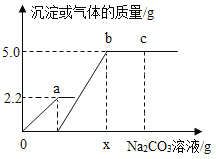
��ͼ��oa�α�ʾ����_______(��������������������)�Ĺ��̣�
��a����Һ������Ϊ_________��
��c����Һ��pH_____7(��>��<��=)��
���𰸡�CaCl2��HCl CaCO3������ˮ ���� ��Һ�е�������CaCl2��HClʱ���μӷ�̪��ҺҲ����ɫ C ������ͭ��������ͭ�� D������Ϊ��ֻ��CaCl2ʱ������������ҺҲ�������ɫ���� ���� NaCl��CaCl2�����Ȼ��ƺ��Ȼ��ƣ� ��
��������
[���������]
����ǰ��IJ��룬���Կ���������ʣ�࣬���Է�Һ�к����Ȼ��⣨HCl�����Ȼ��ƣ�CaCl2����
[�����뽻��]
CaCO3������ˮ������������Һ�У�
[ʵ�������]
��1����֤����2����Һ�е�����ֻ��CaCl2��ȡ������Һװ���Թ��У�Ȼ������̪��Һ�����ַ�̪��Һ����ɫ������С����Ϊ����2��ȷ������۴������������Ժ�������Һ������ʹ��̪��Һ��ɫ������̪��Һ����ɫ��Ҳ�������������
��2���ýྻ����IJ�����պȡ����Һ�ε���ʪ��pH��ֽ�ϣ����pH=4����Ϊ����3��������Һ�е�������NaCl��HCl��������ȷ������Һ�м�ˮʱ����Һ��ϡ�ͣ����Ȼ�ı䣬�����ı�����ԣ����������������ȷ��������Һ��ϡ�ͣ����Ա��������ƫ������ȷ����ѡC��
��3���ɽ����Dz���3��ȷ������֪��Һ��������CaCl2��HCl�������Ȼ���һ�����ڣ�����Ҫ��֤���ʡ������ܽ⣬��Һ�����ɫ���������Լ������ᷴӦ�����������Լ�����������ͭ��������ͭ������߶��������ᷴӦ�����Ȼ�ͭ������ɫ��Һ��
[��˼������]
�Ȼ��ƺ��Ȼ��ⶼ��ʹ����������������ϡ����İ�ɫ���������Խ��۲���ȷ��
��4����Na2CO3������HCl��������CaCl2��Ӧ������ͼ��oa�α�ʾ��������Ĺ��̣�
����CaCl2��HCl�Ļ����Һ�м���̼����ʱ����������̼���Ʒ�Ӧ���ɶ�����̼���Ȼ��ơ�ˮ��������ȫ��Ӧ���������̼���ƺ��Ȼ��Ʒ�Ӧ��a���ʾNa2CO3ǡ�������ᷴӦ�����Ȼ��ƻ�û�з�Ӧ������Һ�к���CaCl2��NaCl�������ʣ�
��c����Һ��ʾ̼�����ǹ����ģ���Һ�ʼ��ԣ�����pH��7��

 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�