题目内容
【题目】如图为干电池的结构示意图,请利用所学知识完成下列问题。
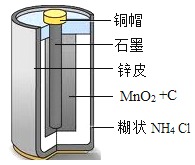
(l)碳棒(主要成分是石墨)可用作干电池的电极,说明石墨具有_____性。
(2)把 NH4Cl配制成溶液,并结合如表填空。
溶液 | K2SO4溶液 | NH4Cl溶液 | 氨水 | K2CO3溶液 |
加入紫色石蕊溶液 | 紫色 | 红色 | 蓝色 | 蓝色 |
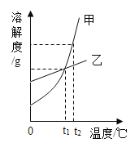
①通过观察如表可知,NH4Cl溶液的 pH_____(填“>”“<”或者“=”)7。
②表中属于碱性氮肥的是_____。
(3)干电池中用到了铜和锌两种金属,请你写出一种证明两种金属活动性强弱的方案_____。
(4)干电池的材料很多可以回收利用。例如:回收的二氧化锰在实验室制取氧气时,所起的作用_____;干电池中的锌壳可以回收用于实验室制取氢气,反应的化学方程式为_____。
【答案】导电 ![]() 氨水 将锌片放入硫酸铜溶液中,锌片上有红色物质析出(或铜放入硫酸锌溶液中,无明显现象) 催化作用 Zn+H2SO4=ZnSO4+H2↑
氨水 将锌片放入硫酸铜溶液中,锌片上有红色物质析出(或铜放入硫酸锌溶液中,无明显现象) 催化作用 Zn+H2SO4=ZnSO4+H2↑
【解析】
(1)碳棒(主要成分是石墨)可用作干电池的电极,说明石墨具有优良的导电性。
(2)①向![]() 溶液溶液中滴加紫色石蕊溶液,变红色,说明溶液显酸性,则
溶液溶液中滴加紫色石蕊溶液,变红色,说明溶液显酸性,则![]() 溶液的
溶液的![]() 。
。
②向氨水中中滴加紫色石蕊溶液,变蓝色,说明溶液显碱性,属于碱性氮肥。
(3)证明两种金属活动性强弱,可将锌片放入硫酸铜溶液中,锌片上有红色物质析出,或将铜放入硫酸锌溶液中,无明显现象,说明锌的金属活动性比铜强。
(4)回收的二氧化锰在实验室制取氧气时,起催化作用;实验室制取氢气,原理是锌与稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为![]() 。
。
故答案为:
(1)导电;
(2)<;氨水;
(3)将锌片放入硫酸铜溶液中,锌片上有红色物质析出![]() 或铜放入硫酸锌溶液中,无明显现象
或铜放入硫酸锌溶液中,无明显现象![]() ;
;
(4)催化作用;![]() 。
。

【题目】工业中利用如下反应合成SO3:2SO2+O2![]() 2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A. 丁物质一定是催化剂V2O5
B. 参加反应的SO2分子、O2分子的个数比为2:1
C. 丙物质是O2
D. d=15