题目内容
【题目】(8分)铝制品在日常生活中应用广泛,但铝制品却不宜长时间盛放腌制食品。资料显示:“铝制品表面虽然有一层致密的氧化膜保护……氯化钠也会破坏氧化膜的结构,加速铝制品的腐蚀。”
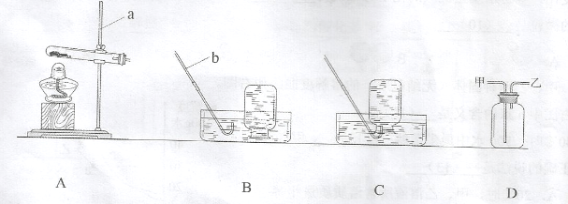
【提出问题】氯化钠溶液中的哪一种离子对氧化膜产生了破坏作用?
【实验方案】
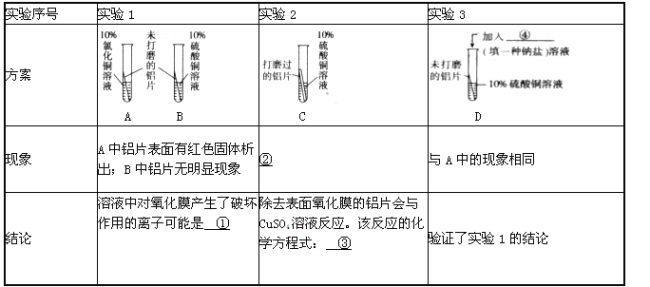
【反思】针对实验3,莹莹认为还应增做一个对比实验,她的方案是向B试管中再加入Na2SO4溶液,结果无明显现象。该实验可证明溶液中对氧化膜不产生破坏作用的离子是____。
【定量计算】现有一块表面被氧化的铝片4克,放入到100克足量的稀盐酸溶液的烧杯中,待固体完全消失后,称得烧杯中剩余物的总质量为l03.7克,求该铝片中氧化铝的质量。
【答案】①Cl-(氯离子)
②铝片表面有红色固体析出
③2A1+3CuSO4===A12(SO4)3+3Cu
④氯化钠(NaCl)
⑤钠离子(Na+)或硫酸根离子
【定量计算】1.3克
【解析】
试题分析:①通过对比试管A中加氯化铜溶液,结果A中铝片表面有红色固体析出,而试管B中加硫酸铜溶液,B中铝片无明显现象,故判断溶液中对氧化膜产生了破坏作用的离子可能是Cl-(氯离子)
②经过打磨后的铝片,这样就将表面的氧化铝去除了,所以看到的现象:铝片表面有红色固体析出;该反应的化学方程式:2A1+3CuSO4===A12(SO4)3+3Cu
④要验证了实验1的结论,肯定是加一种含有氯离子的盐溶液,故可加入氯化钠(NaCl)
⑤针对实验3,莹莹认为还应增做一个对比实验,她的方案是向B试管中再加入Na2SO4溶液,结果无明显现象。该实验可证明溶液中对氧化膜不产生破坏作用的离子是钠离子(Na+)或硫酸根离子
【定量计算】根据质量守恒定律:化学反应前后,物质的总质量不变,故可判断反应生成的氢气质量=4克+100克-l03.7克=0.3克,然后根据化学方程式:2Al + 6HCl === 2AlCl3 + 3H2↑中Al与H2的质量关系,即可求出Al的质量,进一步计算该铝片中氧化铝的质量
解:设Al的质量为x
2Al + 6HCl === 2AlCl3 + 3H2↑
54 6
x 0.3克
54:6=x:0.3克
x=2.7克
铝片中氧化铝的质量=4克-2.7克=1.3克