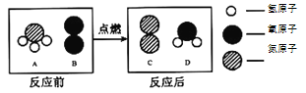
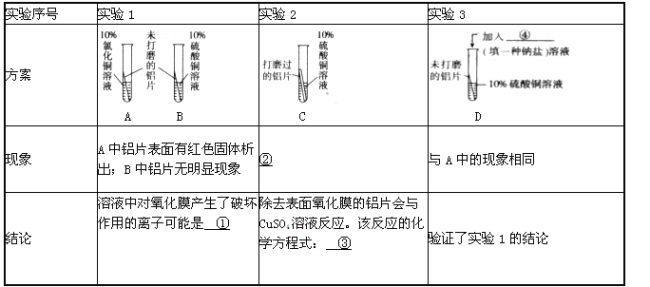
题目内容
【题目】(13分)下面是实验室制取和收集气体的装置,根据所学知识回答下列问题:
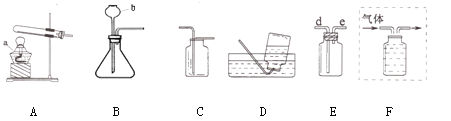
(1)写出仪器的名称:a ;b
(2)从上图中选择装置制取并收集干燥的CO2,应选用图中的 (填字母)。
(3)实验室若用装置E收集H2,气体应从导管的 (填“d”或“e”)端进入。
(4)若制取的O2用B装置制取的反应原理 ,用F装置排水法收集,请将图F补画完整(直接在图中画出)。
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。请完成下列计算内容:(写出计算过程)
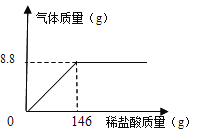
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
【答案】(1)a、酒精灯 b、长颈漏斗
(2)BEC
(3)e
(4)2H2O2 MnO2 2H2O + O2 ↑
(5)①80% ②10%
【解析】
试题分析:(1)常见仪器的识记:a、酒精灯 b、长颈漏斗
(2)气体发生装置的选择依据:反应物的状态和反应条件,制取CO2是采用固体大理石和液体稀盐酸在常温下反应,故选发生装置B,收集装置的选择依据:气体的密度和溶解性,由于二氧化碳的密度比空气大且能溶于水,故选收集装置C ,再加上要干燥,故还需选 E
(3)由于氢气的密度比空气小,若用装置E收集H2,气体应从导管的e端进入
(4)若制取的O2用B装置制取,说明是采用过氧化氢溶液和二氧化锰混合,反应原理:2H2O2 MnO2 2H2O + O2 ↑,用F装置排水法收集,固定从短管进,所以只需将出气管延长至瓶底即可,图略
(5)根据图像可知,当反应结束产生的二氧化碳气体质量为8.8g,根据化学反应方程式:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑中CO2与CaCO3、HCl的质量关系,可分别求出CO3、HCl的质量,进一步可分别求出样品中碳酸钙的质量分数及所用稀盐酸溶质的质量分数
解:设碳酸钙的质量为x,HCl的质量为y
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 73 44
x y 8.8g
①100:44=x:8.8g x=20g
样品中碳酸钙的质量分数=20g/25g×100%=80%
② 73:44=y:8.8g y=14.6g
所用稀盐酸溶质的质量分数=14.6g/146×100%=10%
答:略

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案