题目内容
【题目】下列图象能正确反映其对应关系的是
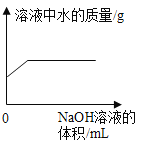
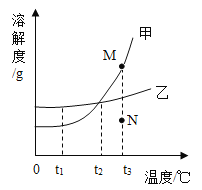
A.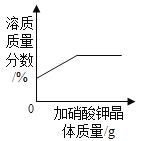 表示某温度下,向一定量的硝酸钾不饱和溶液中不断加入硝酸钾晶体
表示某温度下,向一定量的硝酸钾不饱和溶液中不断加入硝酸钾晶体
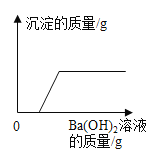
B. 表示向稀盐酸和氯化铜的混合溶液中加入过量的氢氧化钠溶液
表示向稀盐酸和氯化铜的混合溶液中加入过量的氢氧化钠溶液
C.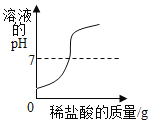 表示向氢氧化钠溶液中滴加过量的稀盐酸
表示向氢氧化钠溶液中滴加过量的稀盐酸
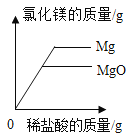
D. 表示向相同质量和相同溶质质量分数的稀硫酸中,分别加入过量镁粉和铝粉
表示向相同质量和相同溶质质量分数的稀硫酸中,分别加入过量镁粉和铝粉
【答案】AD
【解析】
A、不饱和的硝酸钾溶液中,加入硝酸钾固体还能继续溶解,所以溶质的质量分数增大,等到饱和后硝酸钾不会再溶解,所以溶质的质量分数也不会改变,选项A正确。
B、氯化铜溶液可以和氢氧化钠溶液反应生成氢氧化铜沉淀,但是氢氧化铜能够溶于稀盐酸,所以开始加入氢氧化钠溶液时溶液中不会产生沉淀,直至把稀盐酸消耗完全后才会产生沉淀,所以生成沉淀的质量不应该从0开始,选项B错误。
C、向氢氧化钠溶液加入过量稀盐酸,开始溶液的pH大于7,选项C错误。
D、将镁片和铝片(过量)分别和等质量、等溶质质量分数的稀硫酸反应,则酸全部参加反应,硫酸的质量相同,所含有的氢元素质量相等,故最后生成的氢气质量相同,图像反映的是金属质量和生成气体之间的关系,当加入少量金属时,等质量的铝和镁,铝产生的氢气比镁多,因此铝所对应的曲线应该在镁上面,另一方面金属过量,产生的氢气质量相等,消耗铝的质量比镁少,该图像符合这个特点,选项D正确。
故选AD。

 口算题天天练系列答案
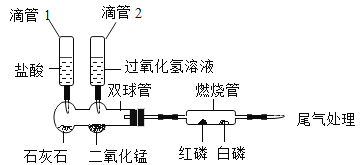
口算题天天练系列答案【题目】实验小组同学验证Ca(OH)2溶液导电性的实验装置如图1所示。实验观察到灯泡变亮的同时,两个电极上均有气体产生,且阳极附近出现了白色浑浊。小组同学对白色浑浊物的成分进行了如下探究。
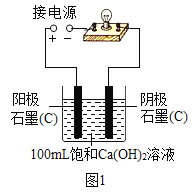
(猜想一)甲同学认为:白色浑浊物是Ca(OH)2。
(实验一)为了验证甲同学的猜想,进行如下实验。取少量白色浊液于试管中,加入足量水,充分振荡,观察到仍有白色浑浊。
(猜想二)乙同学认为:白色浑浊物中含有CaCO3。
(实验二)为了验证乙同学的猜想,进行如下实验。取少量白色浊液于试管中,滴加稀盐酸,白色浑浊消失,没有观察到有气泡产生。
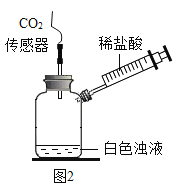
(实验三)为了进一步验证乙同学的猜想,进行如下实验。
实验装置图 | 实验操作 | 实验现象 |
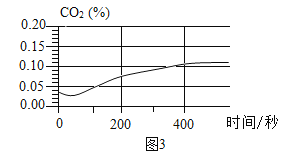
| 将注射器内稀盐酸推入瓶中,并用二氧化碳传感器测得装置内二氧化碳的体积分数 | I.白色浑浊消失,没有观察到有气泡产生 II.检测到二氧化碳含量随时间的变化如下图所示
|
(解释与结论)
(1)用石墨电极验证Ca(OH)2溶液的导电性实验时,两个电极上产生大量气体,发生的是电解水的反应,写出反应的化学方程式________。
(2)甲同学提出白色浑浊为Ca(OH)2的理由是_____。
(3)由实验三得出的结论是____,相关反应的化学方程式为____。
(反思与交流)
(4)实验二中没有观察到明显气泡的可能原因是____。
(5)丙同学为了进一步探究白色浑浊物产生的原因,用铂(Pt)电极代替石墨(C)电极完成图1所示实验,其目的是________。
【题目】分析数据,获得信息实验室现有硫酸铜和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸铜的质量分数。先称取该混合物样品 25g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液 100g 平均分四次加入其中,充分振荡,相关实验数据记录如下:
第1次 | 第2次 | 第3次 | 第4次 | |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 4.9 | 9.8 | X | 14.7 |
请回答下列问题:
(1)上表中 X 的数值为_____________;
(2)计算原固体混合物样品中硫酸铜的质量分数为_____________? (写出计算步骤)