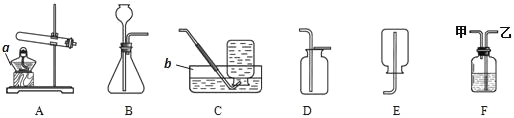
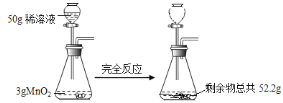
题目内容
【题目】(1)盛有石灰水的试剂瓶常有一层白色固体,该固体物质是怎样形成的_____?可以用什么方法除去_____?写出相应的化学方程式_____。
(2)实验室的废硫酸不能直接倒入下水道(为铁制管道)因为_____?
【答案】石灰水中的溶质是氢氧化钙,氢氧化钙与空气中的二氧化碳反应生成碳酸钙和水,碳酸钙不溶于水,所以看到的是白色固体碳酸钙 加入稀盐酸,然后清洗 ![]() 硫酸具有腐蚀性,硫酸能和铁反应生成氯化亚铁和氢气,会腐蚀下水道
硫酸具有腐蚀性,硫酸能和铁反应生成氯化亚铁和氢气,会腐蚀下水道
【解析】
石灰水长时间放置会吸收空气中的二氧化碳,反应生成碳酸钙沉淀和水,除去碳酸钙要加稀盐酸,反应生成氯化钙和水和二氧化碳,废硫酸具有腐蚀性,倒入下水道会腐蚀下水道,应倒入指定的试剂瓶中。
(1)盛有石灰水的试剂瓶常有一层白色固体,石灰水中的溶质是氢氧化钙,氢氧化钙与空气中的二氧化碳反应生成碳酸钙和水,碳酸钙不溶于水,所以看到的是碳酸钙固体,除去碳酸钙要加稀盐酸,反应生成氯化钙和水和二氧化碳,然后清洗,化学方程式为![]() 。
。
(2)实验室的废硫酸不能直接倒入下水道,废硫酸具有腐蚀性,硫酸能和铁反应生成硫酸亚铁和氢气,倒入下水道会腐蚀下水道,应倒入指定的试剂瓶中。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】金属材料包括纯金属以及它们的合金。
(1)在金属中加热熔合某些___,就可以制得具有金属特征的合金。
(2)铁制品锈蚀的过程,实际上是铁与空气中的___发生化学反应的过程。
(3)焊锡(锡铅合金)主要用于焊接金属,武德合金(铅、铋、锡和镉组成的合金)可用于制电路保险丝。根据下表提供的数据,可知合金的熔点一般___。
金属材料 | 纯金属 | 合金 | ||||
铅 | 镉 | 铋 | 锡 | 焊锡 | 武德合金 | |
熔点/℃ | 327 | 321 | 271 | 232 | 183 | 70 |
(4)1756年,俄国化学家罗蒙诺索夫把锡(Sn)放在密闭容器里煅烧,发现容器和容器里的物质的总质量在煅烧前后并没有发生变化。
①锡煅烧生成一种氧化物,其中锡元素的化合价为+4,该氧化物的化学式为___。
②罗蒙诺索夫认为在化学变化中物质的质量是守恒的。除了物质的质量以外,化学反应前后肯定没有变化的是___(填字母)。
A 原子数目 B 分子数目 C 原子种类 D 元素种类
(5)铁与硫酸铜溶液的反应在质量守恒定律的验证中起着重要的作用。若1.4g铁粉能与50g硫酸铜溶液恰好完全反应,则该硫酸铜溶液中溶质的质量分数是___?(写出计算过程)
【题目】学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊。甲组同学进行如图所示的实验,却未观察到预期现象。
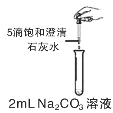
(提出问题)未观察到浑浊的原因是什么?
(猜想和假设)
①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。
②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。经讨论,同学们认为猜想①不合理,其理由是_______。
(进行实验)乙组同学针对猜想②进行实验。
实验目的 | 实验操作 | 实验现象 | |
探究猜想② | 取4支试管,向其中分别加入…… | 碳酸钠溶液浓度/% | 是否浑浊 |
10 | 不浑浊 | ||
5 | 不浑浊 | ||
1 | 浑浊 | ||
0.5 | 浑浊 | ||
(解释与结论)
(1)补全上述实验操作“……”部分:取4支试管,向其中分别加入2mL,浓度为10%,5%,1%,0.5%的碳酸钠溶液,再分别滴加_______。
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是_______。
(3)乙组实验证明:猜想②_____(填“成立”或“不成立”)。理由是_______。
(实验反思)
(4)丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:
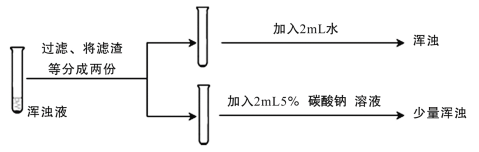
丙组同学的实验结论是_______。
(5)依据乙、丙两组的实验探究,丁组同学仍使用甲组的仪器和药品对甲组实验进行了改进,当滴入几滴某溶液后,溶液迅速变浑浊。其实验操作是_______