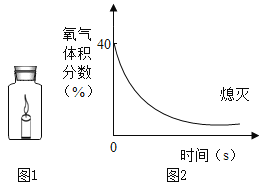
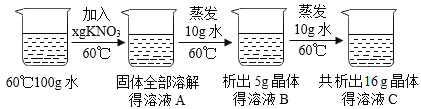
题目内容
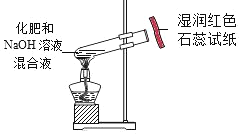
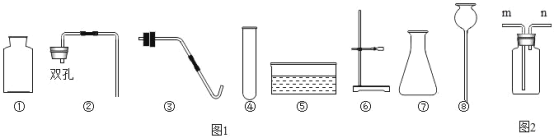
【题目】实验室用锌粒和足量的稀硫酸反应,制取氢气并还原4.0g氧化铜,实验装置如下(装置气密性良好,夹持仪器省略)。
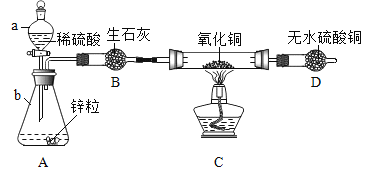
(1)仪器a的名称_______,仪器 b的名称__________。
(2) 锥形瓶中反应的化学方程式是__________,生石灰的作用是_________。
(3)要通入氢气一段时间后才能点燃酒精灯,目的是________,玻璃管中反应的化学方程式是________。
(4)为确定实验结束后氧化铜是否已基本消耗完,请设完成下表中两种不同的方案。
操作 | 判断依据 | 结论 | |
方案一 | 玻璃管中固体取样,加稀盐酸 | 现象:_______ | CuO已消耗完 |
方案二 | 称量玻璃管中残留固体质量 | 固体质量为____g |
【答案】分液漏斗 锥形瓶 ![]() 干燥生成的氢气 将装置内的氢气排尽,防止氢气混有一定量的空气,遇明火发生爆炸
干燥生成的氢气 将装置内的氢气排尽,防止氢气混有一定量的空气,遇明火发生爆炸 ![]() 固体不溶解;溶液未变蓝 3.2
固体不溶解;溶液未变蓝 3.2
【解析】
(1)仪器a的名称是分液漏斗;仪器 b的名称是锥形瓶;
(2)锥形瓶中为锌粒与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:![]() ;生石灰具有吸水性,可以干燥生成的氢气;
;生石灰具有吸水性,可以干燥生成的氢气;
(3)氢气具有可燃性,混有一定量的空气遇明火,会发生爆炸,故先通氢气一段时间,将装置内的氢气排尽,才能点燃酒精灯;
玻璃管中为氢气与氧化铜反应生成铜和水,该反应的化学方程式为:![]() ;
;
(4)实验结论为:氧化铜已经消耗完,方案一:玻璃管中固体取样,加稀盐酸,由于氧化铜已经消耗完,铜不与稀盐酸反应,故实验现象为:固体不溶解;溶液未变蓝;
方案二:设氧化铜完全反应生成铜的质量为x
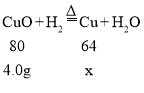
![]()
x=3.2g,由于氧化铜已经消耗完,故称量玻璃管中残留固体质量,固体质量为3.2g。

【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:

部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
(1)熟石灰主要成分的化学式是____________。
(2)溶液A中的阳离子是___________________(填离子符号)。
(3)沉淀C的成分是_____________________。
(4)溶液B与熟石灰反应的化学方程式是____________________________________。