题目内容
将一定质量的碳酸钠粉末溶于400克水中配制成溶液,取一半该溶液,向其中加入20%的盐酸若干克,恰好反应完全,放出气体的质量为22克。试计算:
(1)碳酸钠溶液的总质量;
(2)反应后所得溶液中溶质的质量分数。
(1)碳酸钠溶液的总质量;
(2)反应后所得溶液中溶质的质量分数。
(1)506克(1分)(2)14.1%(2分)
分析:根据溶液的均一性,取一半该溶液,即由生成的22g二氧化碳所计算得到的碳酸钠仅为原粉末质量的一半;
恰好完全反应,所以,反应后所得溶液为氯化钠溶液,计算出反应生成氯化钠的质量与溶液质量比.
解答:解:设生成22g二氧化碳消耗碳酸钠的质量为x,消耗盐酸的质量为y,生成氯化钠的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 22g
106:44=x:22g 解之得 x=53g
73:44=y:22g 解之得 y=36.5g
117:44=z:22g 解之得 z=58.5g
碳酸钠溶液的总质量=53×2+400=506g
反应消耗稀盐酸的质量=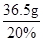 =182.5g
=182.5g
反应后所得溶液中溶质的质量分数=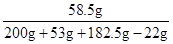 ×100%≈14.1%
×100%≈14.1%
答:(1)Na2CO3溶液的总质量为506克;
(2)反应后所得溶液中溶质的质量分数为14.1%
点评:因为取一半的溶液,即有200g水,53gNa2CO3,182.5g稀盐酸溶液,生成22g二氧化碳逸出,故根据质量守恒定律,反应物物溶液的质量=200g+53g+182.5g-22g=413.5g.
恰好完全反应,所以,反应后所得溶液为氯化钠溶液,计算出反应生成氯化钠的质量与溶液质量比.
解答:解:设生成22g二氧化碳消耗碳酸钠的质量为x,消耗盐酸的质量为y,生成氯化钠的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 22g
106:44=x:22g 解之得 x=53g
73:44=y:22g 解之得 y=36.5g
117:44=z:22g 解之得 z=58.5g
碳酸钠溶液的总质量=53×2+400=506g
反应消耗稀盐酸的质量=
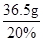 =182.5g
=182.5g反应后所得溶液中溶质的质量分数=
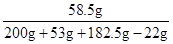 ×100%≈14.1%
×100%≈14.1%答:(1)Na2CO3溶液的总质量为506克;
(2)反应后所得溶液中溶质的质量分数为14.1%
点评:因为取一半的溶液,即有200g水,53gNa2CO3,182.5g稀盐酸溶液,生成22g二氧化碳逸出,故根据质量守恒定律,反应物物溶液的质量=200g+53g+182.5g-22g=413.5g.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
 4Al+3O2。要电解得到54吨铝,需要多少吨氧化铝?
4Al+3O2。要电解得到54吨铝,需要多少吨氧化铝?