题目内容
某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品8 g,把40 g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
(1)上表中 n的数值为 。
(2)样品中碳酸钙的质量分数是 。
(3)求盐酸中溶质的质量分数。
| 序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
| 第1次 | 10 | 5.5 |
| 第2次 | 10 | 3 |
| 第3次 | 10 | 1.4 |
| 第4次 | 10 | n |
(2)样品中碳酸钙的质量分数是 。
(3)求盐酸中溶质的质量分数。
(1) 1.4 (2分) (2)82.5% (2分) (3)由试题分析每10g稀盐酸恰好能与石灰石中的2.5g碳酸钙完全反应
解:设盐酸溶液中溶质的质量分数为x。
CaCO3 + 2HCl ==CaCl2+H2O+CO2↑ (1分)
100 73
2.5g 10g x (2分)
100∶73="=" 2.5g∶(10g x)
x==18.25% (2分)
解:设盐酸溶液中溶质的质量分数为x。
CaCO3 + 2HCl ==CaCl2+H2O+CO2↑ (1分)
100 73
2.5g 10g x (2分)
100∶73="=" 2.5g∶(10g x)
x==18.25% (2分)
(1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为2.5g,而第3次反应后固体物质减少的质量为1.6g,说明此时碳酸钙已反应完,不再产生气体,故表中n的数值为1.4.
故答案为:1.4.
(2)样品中碳酸钙的质量分数=
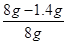 ×100%=82.5%.
×100%=82.5%.答:样品中碳酸钙的质量分数为82.5%.
(3)由试题分析10g稀盐酸恰好能与石灰石中的2.5g碳酸钙完全反应
解:设第一次参与反应的HCl质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
2.5g x
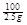 =
=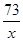 ,
,解之得:x=1.825g,
盐酸中溶质的质量分数为:
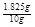 ×100%=18.25%.
×100%=18.25%.答:盐酸中溶质的质量分数为18.25%.
故答案为:(1)1.4
(2)82.5%
(3)18.25%
点评:本题主要考查学生利用化学方程式和溶质的质量分数公式进行计算的能力.

练习册系列答案
相关题目

 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为