题目内容
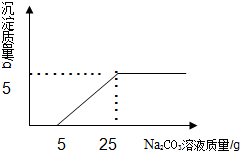
甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的实验数据如下表:
试回答下列问题:
(1)上述实验中,__________同学所用的氢氧化钠溶液一定过量。
(2)求原固体样品中氯化镁的质量分数。
(3)计算乙同学实验后所得溶液中的溶质的质量分数。(计算结果保留小数点后一位)
| | 甲 | 乙 | 丙 |
| 加入氢氧化钠溶液质量 (g) | 20.0 | 40.0 | 60.0 |
| 反应得到沉淀的质量 (g) | 1.45 | 2.9 | 2.9 |
(1)上述实验中,__________同学所用的氢氧化钠溶液一定过量。
(2)求原固体样品中氯化镁的质量分数。
(3)计算乙同学实验后所得溶液中的溶质的质量分数。(计算结果保留小数点后一位)
(1) _丙___(1分)
(2)计算出氯化镁4.75g得1分质量分数95%得1分
(3)计算出氯化钠质量分数9.8%得1分,格式分1分
(2)计算出氯化镁4.75g得1分质量分数95%得1分
(3)计算出氯化钠质量分数9.8%得1分,格式分1分
析:(1)分析表中生成沉淀与所加氢氧化钠溶液的关系,判断出所用的氢氧化钠溶液一定过量的一组实验;
(2)根据加入40.0g氢氧化钠溶液氯化镁恰好完全反应,由氢氧化镁沉淀的质量计算样品中氯化镁质量,氯化镁质量与样品质量比可计算原固体样品中氯化镁的质量分数;
(3)乙同学实验中氢氧化钠与氯化镁恰好完全反应,反应后所得溶液为氯化钠溶液,其中的溶质的质量分数= ×100%,其中氯化钠质量为样品中氯化钠与反应生成氯化钠质量和.
×100%,其中氯化钠质量为样品中氯化钠与反应生成氯化钠质量和.
解答:解:(1)由甲的实验数据可知,加入20.0g氢氧化钠溶液可生成1.45g沉淀;乙实验加入40.0g氢氧化钠溶液得到2.9g沉淀,而丙实验加入60.0g氢氧化钠溶液,得到沉淀质量仍为2.9g,因此可确定丙所用氢氧化钠溶液一定过量,且乙实验中氢氧化钠与氯化镁恰好完全反应;
故答案为:丙;
(2)设生成2.9g氢氧化镁沉淀时,消耗氯化镁的质量为x
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58
x 2.9g
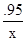 =
=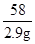 x=4.75g
x=4.75g
原固体样品中氯化镁的质量分数=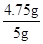 ×100%=95%
×100%=95%
(3)设设生成2.9g氢氧化镁沉淀时,同时生成氯化钠的质量为y
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
58 117
2.9g y
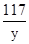 =
=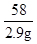
y=5.85g
乙同学实验后所得溶液中的溶质的质量分数=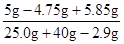 ×100%=9.8%
×100%=9.8%
答:(2)原固体样品中氯化镁的质量分数为95%;(3)乙同学实验后所得溶液中的溶质的质量分数为9.8%.
(2)根据加入40.0g氢氧化钠溶液氯化镁恰好完全反应,由氢氧化镁沉淀的质量计算样品中氯化镁质量,氯化镁质量与样品质量比可计算原固体样品中氯化镁的质量分数;
(3)乙同学实验中氢氧化钠与氯化镁恰好完全反应,反应后所得溶液为氯化钠溶液,其中的溶质的质量分数=
 ×100%,其中氯化钠质量为样品中氯化钠与反应生成氯化钠质量和.
×100%,其中氯化钠质量为样品中氯化钠与反应生成氯化钠质量和.解答:解:(1)由甲的实验数据可知,加入20.0g氢氧化钠溶液可生成1.45g沉淀;乙实验加入40.0g氢氧化钠溶液得到2.9g沉淀,而丙实验加入60.0g氢氧化钠溶液,得到沉淀质量仍为2.9g,因此可确定丙所用氢氧化钠溶液一定过量,且乙实验中氢氧化钠与氯化镁恰好完全反应;
故答案为:丙;
(2)设生成2.9g氢氧化镁沉淀时,消耗氯化镁的质量为x
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58
x 2.9g
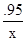 =
=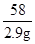 x=4.75g
x=4.75g原固体样品中氯化镁的质量分数=
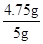 ×100%=95%
×100%=95%(3)设设生成2.9g氢氧化镁沉淀时,同时生成氯化钠的质量为y
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
58 117
2.9g y
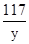 =
=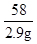
y=5.85g
乙同学实验后所得溶液中的溶质的质量分数=
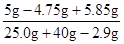 ×100%=9.8%
×100%=9.8%答:(2)原固体样品中氯化镁的质量分数为95%;(3)乙同学实验后所得溶液中的溶质的质量分数为9.8%.

练习册系列答案
相关题目