题目内容
(6分)某工厂排放的废水中含有氯化氢(HCl),现取废水20.0 g,向其中加入40.0 g质数分数为10%的氢氧化钠溶液恰好完全反应(NaOH+HCl===NaCl+H2O)。计算:20.0 g废水中氯化氢的质量。(相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5)
(6分)解:设20.0g废水中氯化氢的质量为x。
反应的NaOH的质量:40.0×10%=4.0g
NaOH+HCl===NaCl+H2O
40 36.5
4.0g x
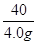 =
=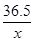
解得:x=3.65g
答:略。
反应的NaOH的质量:40.0×10%=4.0g
NaOH+HCl===NaCl+H2O
40 36.5
4.0g x
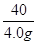 =
=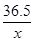
解得:x=3.65g
答:略。
根据已知条件40.0g质数分数为10%的氢氧化钠溶液的质量计算出含溶质氢氧化钠的质量,再根据方程式计算出参加反应的氯化氢的质量.
解:设20.0g废水中氯化氢的质量为x.
反应的NaOH的质量:40.0×10%=4.0g
NaOH+HCl═NaCl+H2O
40 36.5
4.0g x
根据:40:36.5=4.0g:x
解得:x=3.65g
答:20.0g废水中氯化氢的质量为3.65g.
故答案为:3.65g.
点评:解答本题的关键是计算出含纯溶质氢氧化钠的质量,再根据方程式计算出需要参加反应的氯化氢的质量.
解:设20.0g废水中氯化氢的质量为x.
反应的NaOH的质量:40.0×10%=4.0g
NaOH+HCl═NaCl+H2O
40 36.5
4.0g x
根据:40:36.5=4.0g:x
解得:x=3.65g
答:20.0g废水中氯化氢的质量为3.65g.
故答案为:3.65g.
点评:解答本题的关键是计算出含纯溶质氢氧化钠的质量,再根据方程式计算出需要参加反应的氯化氢的质量.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
 2H2O+O2↑
2H2O+O2↑