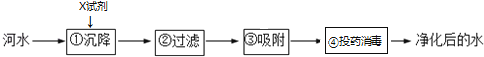
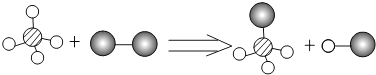
题目内容
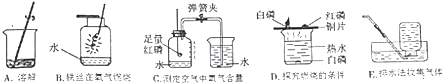
【题目】硫酸是常见的酸,也是常用的化工原料,由于浓度不同,浓硫酸与稀硫酸在在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等,某课外兴趣小组为了探究浓硫酸的某些特性做了如下﹣些实验,请结合有关实验,按要求回答下列问题: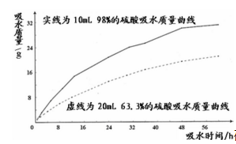
(1)在洗气瓶中盛放浓硫酸,除去氢气或氧气中的水分,是利用其性
(2)探究浓疏酸的吸水性.兴趣小组把98%的硫酸10mL和63.3%的硫酸(用10mL98%的硫酸与10mL水配成)约20mL分别放入两个形态的大表面皿中,称量、观察、记录、分析.根据室温环境下实验的数据绘制成的曲线如图:
①稀释浓硫酸时,应将缓缓地注入盛有的烧杯中并不断搅拌
②由如图曲线你能得到的实验结论有(填序号)
A.只有浓硫酸具有吸水性
B.浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大)
C.开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越强
D.硫酸浓度越稀,吸水性越弱,到﹣定浓度就失去吸水性.
【答案】
(1)吸水
(2)浓硫酸;水;BD
【解析】解:(1)浓硫酸具有吸水性,除去氢气或氧气中的水分,是利用其吸水性,起到干燥剂的作用;(2)①因为浓硫酸溶解会放出大量的热,密度比空气大,为防止酸溅出,因此浓硫酸的稀释时应酸入水并不断搅拌使溶解时产生的热量尽快散失;②从曲线观察两种不同的酸的吸水情况的变化可知:浓硫酸和一定浓度以上的稀硫酸都具有吸水性;浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大);开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越弱;硫酸浓度越稀吸水性越弱,到一定浓度后就失去吸水性;硫酸吸水能力可能会受环境温度、湿度、气压、酸的用量、表面积等因素的影响等.
答案:(1)吸水;(2)①浓硫酸,水;②BD

【题目】实验室有一瓶久置的初中化学常用的无色溶液,其残缺的标签中只剩下“Na”和“10%”等字样,小昊和小宇同学对此很感兴趣,决定探究其成分.
【提出问题】这瓶试剂可能是什么溶液呢?
(1)【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 .
A.酸
B.碱
C.盐
(2)【查阅资料】
①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3 .
②Na2CO3和NaHCO3溶液呈碱性.
③测定室温(20℃)时,四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
【理论探讨】小昊根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 .
(3)【实验探究】
①小宇用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得PH>7,这瓶试剂不可能是 .
②小昊为了确定该溶液是哪种溶液,他又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 , 反应的化学方程式 . |
(4)【拓展与应用】确定该溶液的成分,小宇同学选择了另一种不同物种类别的试剂是 , 对应的现象是 .
(5)【反思与评价】小飞认为由于试剂久置,上述探究得到的结论不可靠,他的理由是(用化学方程式表示) .