题目内容
【题目】热量的生活和生产都离不开金属材料,铜是人类最早利用的金属之一
(1)如图1铜制品中,利用金属能导电的是(填字母序号)
(2)“湿法炼铜”原理是硫酸铜溶液与铁反应,该反应的化学方程式为
(3)利用废旧电池铜帽(含Cu、Zn)制作海绵铜(Cu),丙得到硫酸锌溶液,主要流程如图2(反应条件已略去):
已知:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
①物质B的成分是(填化学式)
②A→E中含铜、锌两种元素的物质有(填字母序号)
【答案】
(1)B
(2)CuSO4+Fe=FeSO4+Cu
(3)Zn;AC
【解析】解:(1)利用铜的导热性可以做成火锅;(2)古代劳动人民发明的“湿法炼铜”的原理是铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═Cu+FeSO4 . (3)由题意可知,含Cu、Zn铜帽与稀硫酸和氧气反应生成了硫酸铜和硫酸锌的混合液A,根据实验的目的,为了得到铜和硫酸锌,应向A溶液加入过量的物质B是锌,通过过滤得到了硫酸锌溶液和铜锌的固体混合物C,为了得到铜和硫酸锌,应加入稀硫酸,所以:
①物质B的成分是Zn;
②A→E中含铜、锌两种元素的物质有AC.
所以答案是:(1)B;(2)Fe+CuSO4=FeSO4+Cu;(3)Zn;②AC.
【考点精析】解答此题的关键在于理解金属的物理性质及用途的相关知识,掌握金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽.(2)大多数呈银白色(铜为紫红色,金为黄色)(3)有良好的导热性、导电性、延展性,以及对金属材料的选择依据的理解,了解黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.

【题目】一些食物的近似pH值如下,下列说法中不正确的是( )
食物 | 葡萄汁 | 苹果汁 | 牛奶 | 鸡蛋清 |
pH | 3.5~4.5 | 2.9~3.3 | 6.3~6.6 | 7.6~8.0 |
A.葡萄汁比苹果汁的酸性强
B.葡萄汁和苹果汁都能使石蕊试液变红
C.牛奶和鸡蛋清都接近中性
D.胃酸过多的人应少饮苹果汁
【题目】大海里蕴藏着丰富的资源,探究学习小组以含有Ca2+、Mg2+、Cl﹣的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2 , 流程如图1: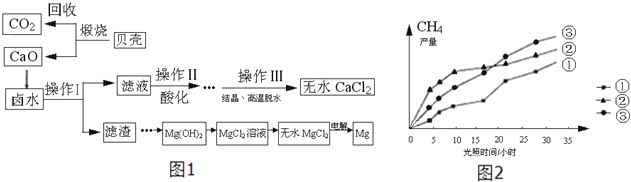
请回答下列问题:
(1)操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒、 .
(2)以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式 .
(3)操作Ⅱ酸化时应选择的酸是(填写化学式).
(4)电解熔融MgCl2的化学方程式是;若要验证镁、铁、铜的活动性顺序,选择铁丝后,还要选择、两种溶液.
(5)Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物,某些阻燃剂(阻碍燃烧的物质)的有效成分是Mg(OH)2 . 你认为Mg(OH)2能够阻燃的原因可能是(选填序号)
a.Mg(OH)2分解需要吸收大量的热,降低了可燃物的着火点
b.生成的氧化镁覆盖在可燃物表面,隔绝了空气
c.生成的水蒸气降低了可燃物周围氧气浓度
d.反应因吸热降低了环境温度,使可燃物不易达到着火点
(6)上述流程图中未涉及的基本反应类型是(填写字母标号)
a.复分解反应 b.置换反应 c.化合反应 d.分解反应
(7)已知T℃时四种化合物在水中和液氨中的溶解度如下表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O(l) | 170g | 92.0g | 1.50×10﹣4g | 33.3g |
NH3(l) | 86.0g | 97.2g | 0.80g | 0.00g |
上述四种物质能在液氨中发生复分解反应的化学方程式为 .
(8)回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成CH4和O2 , 该反应的化学方程式为 , 紫外线照射时,在不同催化剂(①、②、③)的作用下, CH4产量随光照时间的变化如图2所示,在第10小时时CH4产量最高是(填写“①”、“②”、或“③”).
(9)尿素[CO(NH2)2]对提高粮食产量具有重要的作用.人们控制条件可以使CO2和物质M发生反应:CO2+2M═CO(NH2)2+H2O,物质M的化学式为什么?若CO2转化率为90%,则生产1吨尿素所需CO2的质量是多少?写出计算过程.