题目内容
【题目】水和我们的生活密切相关.请你回答:
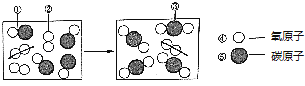
(1)电解水实验中,产生的氢气和氧气的体积比是 , 该实验说明水是由元素组成的,写出该实验的化学方程式 .
(2)自来水厂净化水的主要步骤如图所示,有关说法错误的是 . 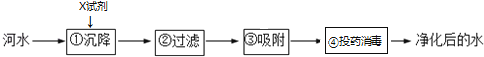
A.步骤②可除去难溶性杂质
B.X试剂可以是明矾
C.步骤③发生了化学变化
D.净化后的水是纯净物.
【答案】
(1)2:1;氢、氧;2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
(2)C,D
【解析】解:(1)电解水实验中,产生的氢气和氧气的体积比是2:1,该实验说明水是由氢、氧元素组成的,水在通电的条件下生成氢气和氧气,化学方程式为:2H2O ![]() 2H2↑+O2↑;(2)A、步骤①②可除去难溶性杂质,故A正确;B、步骤①中可加入明矾作絮凝剂,故B正确;C、步骤③是吸附,发生的是物理变化,故错误;D、净化后的水含有可溶性杂质,不是纯净物,故D错误.故选:CD. 所以答案是:(1)2:1,氢、氧,2H2O
2H2↑+O2↑;(2)A、步骤①②可除去难溶性杂质,故A正确;B、步骤①中可加入明矾作絮凝剂,故B正确;C、步骤③是吸附,发生的是物理变化,故错误;D、净化后的水含有可溶性杂质,不是纯净物,故D错误.故选:CD. 所以答案是:(1)2:1,氢、氧,2H2O ![]() 2H2↑+O2↑;(2)CD.
2H2↑+O2↑;(2)CD.
【考点精析】关于本题考查的过滤操作的注意事项和电解水实验,需要了解过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;电解水的实验:A.装置―――水电解器B.电源种类---直流电C.加入硫酸或氢氧化钠的目的----增强水的导电性D.化学反应:2H2O=== 2H2↑+ O2↑才能得出正确答案.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目