题目内容
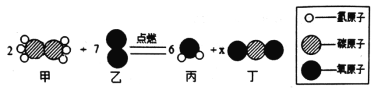
【题目】航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)的混合物作固体燃料,加热铝粉使其被氧气氧化,放出大量的热,促使混合物中高氯酸铵受热分解,同时生成四种气体:两种是空气中的主要成分,一种气体是氯气(Cl2),还有一种气体是水蒸气,因而产生巨大的推动力,试写出其中涉及的化学反应方程式:
(1)铝粉被氧气氧化成氧化铝______________________________。
(2)高氯酸铵受热分解______________________________。
【答案】(1)4Al+3O2![]() 2Al2O3
2Al2O3
(2)2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O↑
N2↑+2O2↑+Cl2↑+4H2O↑
【解析】
试题此题为信息给予题,考查学生阅读信息、分析解决问题的能力。解题的关键在于通过阅读,分析信息,弄清反应物是什么,生成了什么物质。由题意知,铝粉被氧气氧化成氧化铝,反应物为Al、O2,生成物为Al2O3;放出的大量热使高氯酸铵分解,则反应物有NH4ClO4,然后根据质量守恒定律和所学知识确定生成物为N2、O2、Cl2、H2O。确定反应物、生成物后按题目所给条件正确书写化学方程式。书写化学方程式的步骤一般有四步:
1、根据实验事实,在式子的左、右两边分别写出反应物和生成物的化学式。
2、配平化学方程式。
3、标明化学反应发生的条件,如点燃、加热(常用“△”号表示)、催化剂、通电等。
4.注明生成物中气体或固体的状态符号(即“↑”、“↓”),如果反应物和生成物中都有气体或固体时,其状态符号就不用标注了。故
(1)铝粉被氧气氧化成氧化铝,反应物为Al、O2,生成物为Al2O3,故4Al+3O2![]() 2Al2O3
2Al2O3
(2)高氯酸铵受热分解,生成N2、O2、Cl2、H2O,故2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O↑
N2↑+2O2↑+Cl2↑+4H2O↑

【题目】化学变化是化学学科最具特色的内容,而质量守恒定律是认识化学变化的一个基本规律,对科学发展具有重大意义.
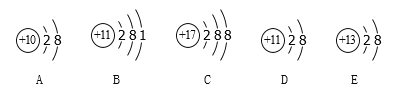
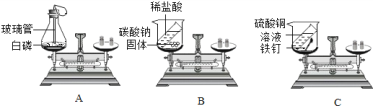
(1)用如图所示的![]() 个实验验证质量守恒定律,其中不能达到实验目的是________(填序号),原因是________.
个实验验证质量守恒定律,其中不能达到实验目的是________(填序号),原因是________.
(2)蜡烛在空气中燃烧时生成二氧化碳和水,由此推断蜡烛中一定含有的元素是________(填元素符号),判断的依据是________.
(3)在密闭容器中放入![]() 、
、![]() 、
、![]() 、
、![]() 四种物质并使其发生反应,测得有关数据如下表.关于此反应的认识正确的是________(填字母序号).
四种物质并使其发生反应,测得有关数据如下表.关于此反应的认识正确的是________(填字母序号).
物质 |
|
|
|
|
反应前的质量 |
|
|
|
|
一段时间后的质量 |
|
|
|
|
A.![]() B.该反应为化合反应
B.该反应为化合反应
C.参加反应的Z与W的质量比是6:11
D.若该反应充分进行,反应后W仍有剩
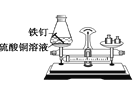
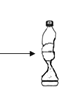
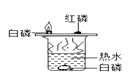
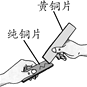
【题目】根据下图所示实验分析得出的结论中,不正确的是
|
|
|
|
A.可以验证质量守恒定律 | B.常温下,二氧化碳能溶于水 | C.只能探究可燃物的燃烧需要的一个条件 | D.黄铜的硬度比纯铜的大 |
A. A B. B C. C D. D
【题目】利用图所示装置(气密性良好)分别进行以下实验,最终U型管中两侧液面的相对高度不正确的是(加入试管中的试剂X所占体积忽略不计)
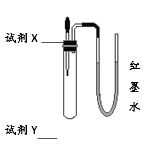
试剂X | 试剂Y | 相对高度 | |
A | 水 | 氧化钙(少量) | 左低右高 |
B | 过氧化氢溶液 | 二氧化锰(少量) | 左低右高 |
C | 稀盐酸 | 石灰石(少量) | 左低右高 |
D | 澄清石灰水 | 二氧化碳 | 左高右低 |
A. A B. B C. C D. D