题目内容
【题目】为了测定某含杂质7%的黄铜样品中铜的质量分数(黄铜主要成分为铜和锌,并含有少量杂质).杂质中不含铜、锌元素,杂质不溶于水,不与其他物质反应,受热也不分解).某化学小组进行了如下实验: 
(1)该黄铜样品中铜的质量分数是多少?
(2)向过滤后所得溶液中加入87.4g水,则最终所得溶液之中溶质的质量分数是多少?
【答案】
(1)解:反应生成氢气的质量为:100g+100g﹣199.6g=0.4g
设合金中锌的质量为x,反应生成氯化锌的质量为y
Zn+2HCl═ | ZnCl2+ | H2↑ |
65 | 136 | 2 |
x | y | 0.4g |
![]()
解得:x=13g
y=27.2g
该黄铜样品中铜的质量分数是 ![]() ×100%=80%
×100%=80%
答:该黄铜样品中铜的质量分数是80%
(2)解:最终所得溶液中溶质的质量分数为: ![]() ×100%=13.6%
×100%=13.6%
答:向过滤后所得溶液中加入87.4g水,则最终所得溶液之中溶质的质量分数是13.6%
【解析】(1)根据质量守恒定律可以计算出反应生成氢气的质量,然后结合反应的化学方程式可以得出求锌的质量比例式;根据锌与杂质的质量分析铜的质量;(2)反应后的溶液为氯化锌溶液,根据化学方程式结合溶液中溶质的质量分数的计算公式可以完成解答.
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

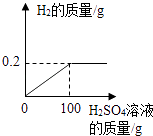
【题目】某兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到实验数据如下.
稀硫酸用量 | 剩余固体质量 |
第一次加入10g | mg |
第二次加入10g | 2.0g |
第三次加入10g | 1.5g |
第四次加入10g | 1.0g |
第五次加入10g | 0.6g |
第六次加入10g | 0.6g |
(1)从以上数据可知,最后剩余的0.6g固体的成分是;这六次实验中,第次加入稀硫酸时样品中的镁已经完全反应;表格中,m= .
(2)计算合金样品中镁的质量分数.
(3)计算所用稀硫酸中H2SO4的质量分数.