题目内容
【题目】兴趣小组的同学研究(Cu﹣Zn合金)样品中锌的含量,取该样品18g跟足量的稀硫酸充分反应,产生氢气的质量与所用稀硫酸的质量关系如图所示.请计算: 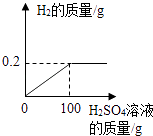
(1)18g该样品中锌的质量.
(2)稀硫酸中溶质的质量分数.
【答案】
(1)解:该样品18g跟足量的稀硫酸充分反应,产生氢气的质量为0.2g.
设18g该样品中锌的质量为x,稀硫酸中溶质的质量为y,
Zn+ | H2SO4=ZnSO4+ | H2↑ |
65 | 98 | 2 |
x | y | 0.2g |
![]() x=6.5g
x=6.5g
![]() y=9.8g
y=9.8g
(2)解:稀硫酸中溶质的质量分数为 ![]() 100%=9.8%
100%=9.8%
【解析】Cu﹣Zn合金中锌的活动性比氢强,能与稀硫酸反应,铜不能;由产生氢气的质量与所用稀硫酸的质量关系图可知,该样品18g跟足量的稀硫酸充分反应,产生氢气的质量为0.2g,恰好完全反应消耗的稀硫酸的质量为100g,据此由锌和稀硫酸反应的化学方程式,进行分析解答.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目