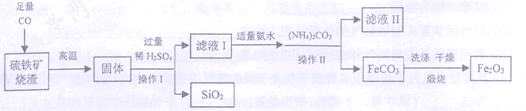
题目内容
【题目】(5分)某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:
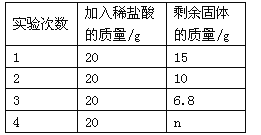
(1)表中 n的数值为 。
(2)样品中碳酸钙的质量分数是 。
(3)求盐酸中溶质的质量分数。
【答案】(1)6.8 (2)66% (3)18.3%
【解析】
试题分析:(1)数据的分析和处理,一定要抓住数据间的规律性, 从1次加入20g稀盐酸,结果剩余固体的质量由20g变为15g,说明反应掉的碳酸钙质量为5g,故第2次加入20g稀盐酸,结果剩余固体的质量由15g变为10g,照这个规律,那么第3次加入20g稀盐酸,剩余固体的质量应由10g变为5g, 可剩余固体质量6.8g,由此可判断这6.8g中应该没有碳酸钙,全是杂质,故表中 n的数值为6.8
(2)样品中碳酸钙的质量分数=(20g-6.8g)/20g×100%=66%
(3)要计算盐酸中溶质的质量分数,那么就要选择一种所加稀盐酸全部反应的数据,经过(1)的分析可知,第1.2次实验所用的稀盐酸完全反应了,然后根据化学方程式:CaCO3 + 2HCl =CaCl2+H2O+CO2↑中CaCO3与HCl的质量关系,先计算出HCl的质量,进一步计算盐酸中溶质的质量分数
解:设盐酸溶液中溶质的质量为x
CaCO3 + 2HCl =CaCl2+H2O+CO2↑
100 73
5g x
100∶73= 5g∶ x
x=3.65g
盐酸溶液中溶质的质量分数=3.65g/20g×100%=18.3%
答:盐酸溶液中溶质的质量分数为18.3%

练习册系列答案
相关题目