题目内容
【题目】某腐蚀印刷电路板的废液中含有CuCl2和FeCl2,为了分析该废液的组成,取1 000 g废液,设计如下实验方案进行探究:
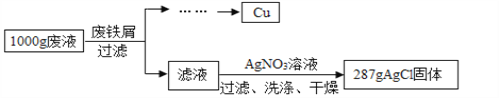
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
废铁屑的质量/g | 20 | 40 | 60 | 80 |
析出Cu的质量/g | 12.8 | 25.6 | 32 | 32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1 000 g废液与足量废铁屑完全反应,析出Cu的质量为_______ g。
(2)废铁屑中单质Fe的质量分数为_______________。
(3)计算1 000 g废液中CuCl2的质量分数_______。(写出计算过程,结果保留小数点后一位)
(4)1 000 g废液中FeCl2的质量分数为_________。(结果保留小数点后一位)
【答案】(1)32g (2)56% (3)6.8% (4)6.4%
【解析】试题分析:从表格看:1000 g废液与足量废铁屑完全反应,析出Cu的质量为32克,从前两组数据看,废铁屑20克可以恰好得到12.8克的铜单质,设生成12.8克的铜需要的铁的质量为X,
Fe+CuCl2==FeCl2+Cu
56 64
X 12.8克
列比例式得:56:X=64::1.8克 X=11.2克 废铁屑中单质Fe的质量分数为=11.2克/20克×100%=56%
设1000 g废液中CuCl2的质量为X,同时生成的氯化亚铁的质量为Y
Fe+CuCl2==FeCl2+Cu
135 127 64
X Y 32克
列比例式得:135:X=64:32克=127:Y 求得X=67.5克 Y=63.5克计算1000 g废液中CuCl2的质量分数=67.5克/1000克×100%=6.8%。
设溶液中FeCl2的质量为X。
FeCl2+2AgNO3="=2AgCl↓" + Fe(NO3)2
127 287
X 287克
列比例式得 127:X=287:287克 求得X=127克 则废液中的氯化亚铁的质量为=127克-63.5克=63.5克
1000 g废液中FeCl2的质量分数为=63.5克/1000克×100%=6.4%。