��Ŀ����
��ͬѧ�Ժ�ʹ���ټ�����ơ���ʹ�֡����ķ���ԭ��������Ũ����Ȥ�����Ǵ��˼�����ʹ�֣�����ʵ���Ҷ�������о���


���������ϡ�
[ �÷����� ] ���ã�һ��1�Ρ������������ȡ��ҩ�����ζ����Σ�ʹҩ������ɢ���Ӵ��������������ȸ�ʱ�����ڹ̶����ڣ�������ʹ������ÿ���ɷ��Ȳ�����15Сʱ��
[ ԭ�ϲ� ] ������ʯ������̿��ˮ�ȡ�
[ ����ԭ�� ] ����������ˮ��Ӧ�����������������壩�������ȡ�
��ʵ��һ����֤��ʹ�ֳɷ����������Ļ�ѧ���ʡ�
ʵ����ۣ�д���˷�Ӧ�����ֱ���ʽ ��
����ƿ�м�ˮ�������� ��
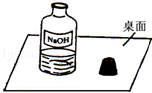
��ʵ������ú�ʹ���ټ�ҩ�۲ⶨ�����������ĺ�����
��ͬѧ���������ͼ��ʾװ�ã�����ʵ�顣
��ʵ���¼
��ʵ�鷴˼����ͬѧ��Ϊ��ͬѧ��������ʹ��ҩ�۲ⶨ�����������ĺ�������ʵ�鲻��֤���������ۣ����������Ľ����ٽ��в������õ��˽�Ϊȷ�Ľ�������Ľ���IJ���Ϊ
��


���������ϡ�
[ �÷����� ] ���ã�һ��1�Ρ������������ȡ��ҩ�����ζ����Σ�ʹҩ������ɢ���Ӵ��������������ȸ�ʱ�����ڹ̶����ڣ�������ʹ������ÿ���ɷ��Ȳ�����15Сʱ��
[ ԭ�ϲ� ] ������ʯ������̿��ˮ�ȡ�
[ ����ԭ�� ] ����������ˮ��Ӧ�����������������壩�������ȡ�
��ʵ��һ����֤��ʹ�ֳɷ����������Ļ�ѧ���ʡ�
| ���� | ʵ����� | ʵ������ |
| | ����ʹ�ִ���ҩ�ﵹ��һ�ձ��У��۲� | ҩ��Ϊ��ɫ�����ĩ |
| | ��һ���δ������ձ��еĺ�ɫ��ĩ��ֽӴ���ȡ���������ڴ����ϵĺ�ɫ��ĩ����ȼ�ճ��У��ھƾ����ϵ�ȼ������ʢ�������ļ���ƿ�У��۲� | ����ȼ�գ� |
ʵ����ۣ�д���˷�Ӧ�����ֱ���ʽ ��
����ƿ�м�ˮ�������� ��
��ʵ������ú�ʹ���ټ�ҩ�۲ⶨ�����������ĺ�����
��ͬѧ���������ͼ��ʾװ�ã�����ʵ�顣

��ʵ���¼
| ���� | ʵ����� | ��Ҫʵ������ | ʵ����ۼ����� |
| | ���Ӻ�װ������ͼ��ʾ��Ȼ�� | | װ�õ����������� |
| | ��������ҩƷ��Ѹ�ٽ��������ϣ�������� | | ���뼯��ƿ��ˮ�������Ϊ�����������ĺ����� |
��ʵ�鷴˼����ͬѧ��Ϊ��ͬѧ��������ʹ��ҩ�۲ⶨ�����������ĺ�������ʵ�鲻��֤���������ۣ����������Ľ����ٽ��в������õ��˽�Ϊȷ�Ľ�������Ľ���IJ���Ϊ
��
[ʵ��һ] �ڻ������䣬�ų����������ɺ�ɫ����
ʵ�����: �� + ����
 ����������
������������ֹƿ��ը��
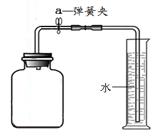
[ʵ���] �����漯��ƿ ˮ�еĵ��ܿ�������ð��
�ڷ��ȣ����ܿ�������ð����һ��ʱ�����Ͳ�е�ˮ�ص��������뵽����ƿ��
[ʵ�鷴˼] �رյ��ɼ�a���������ҩƷ��Ѹ�ٽ��������ϣ������������ȴ����ɼ�a
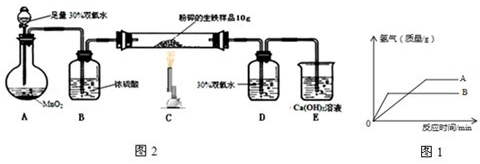
������������������о���ȼ�գ��������䣬�ų��������ȣ�����һ�ֺ�ɫ���壻Ϊ��ֹ��ʵ���в����ij��ȵ�����������ը��ƿ�ף�ͨ��Ҫ�ڼ���ƿ�ڼ���һ������ˮ���ڿ��������������IJⶨʵ���У�����Ҫ����װ�������Եļ�飬���ֽ��漯��ƿ�������Ͳ�ڵĵ����ܿ�������ð��֤��װ�õ����������ã����ݺ�ʹ�ֵ�����ԭ����֪����������ҩƷ��Ѹ�ٽ��������ϣ��������ɹ۲쵽���ȣ����ܿ�������ð����һ��ʱ�����Ͳ�е�ˮ�ص������뵽����ƿ�У���ʵ���������У�ʵ��ʱû�м�ס���ɼУ���ʵ������У�����ƿ�ڵ��������һ�����ܳ�������ʵ�����Ӱ�죬�Ľ�װ��Ӧ�������������˼����

��ϰ��ϵ�д�
�����Ŀ
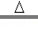 2K2MnO4+K2Mn4O8+4O2��
2K2MnO4+K2Mn4O8+4O2��