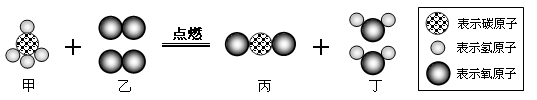
��Ŀ����
����Ŀ����12�֣�С��ͬѧ�ԡ�п�����ᷴӦ������Ӱ�����ء�������̽����
��������⡿п�����ᷴӦ�Ŀ�������Щ���ص�Ӱ���أ�
����������衿
a.��������������������йأ�
b.������п����״�йء�
���������ϡ�
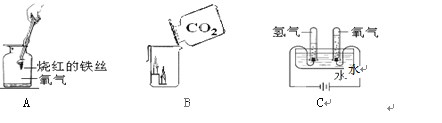
п�Ļ�ѧ���ʱȽϻ��ã��ڳ����µĿ����У���������һ�㡰����Ĥ��������ֹ��һ���������á�����Ĥ�����Ժ��ᷴӦ����������������
����Ʋ�ʵ�顿С���ò�ͬ��������������Ͳ�ͬ��״��п��������ʵ�顣
ʵ���� | �����������������ȡ20mL�� | п����״����ȡ1g�� | ���������(mL)�����ռ�3���ӣ� |
�� | 20% | � | 31.7 |
�� | 20% | пƬ | 50.9 |
�� | 20% | � | 61.7 |
�� | 30% | пƬ | 79.9 |
��1��д��ϡ������п��Ӧ�Ļ�ѧ����ʽ______________________________��
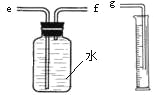
��2��С����ͼװ���ռ������������������������Ͳ��������_______________________��
����Ӧ��________����e��f��g����ͨ�룻
���ռ�֤�ݡ�
��3��Ҫ�Ƚϲ�ͬ��������������Է�Ӧ������Ӱ�죬Ӧѡ���ʵ������____________��
���ó����ۡ�
��4��������_____________________________________________________��
�������뷴˼��
��5���±���С��������ʵ�����ϸ���ݡ�
ʱ�Σ���Ϊ1���ӣ� | ��1���� | ��2���� | ��3���� | ��4���� | ��5���� | ��6���� |
H2����� | 3.1mL | 16.7mL | 11. 9mL | 9.6mL | 7.6mL | 6.0mL |
������п�����ᷴӦ�������������ֱ�����ԭ��___________________________��
��6������Ϊп�����ᷴӦ�Ŀ������ܻ��� ����Ӱ�죿
��7��ȡij��������������Ʒ6g����100g������ϡ�����ַ�Ӧ�Ƶ�ʣ�����ʵ�������Ϊ105.8g��
���������������Ϊ �ˣ�
���ó�������������Ʒ���������������Ƕ��٣���д������Ĺ��̣������ȷ��0.1%��
���ó������������Ƿ�ϸ� ����ϸ��ϸ�
���𰸡���1��Zn+H2SO4==ZnSO4+H2��
��2�������ų�ˮ���������Ϊ��������� f
��3���٢����ڢ�
��4������ԽŨ����ӦԽ�죻��пƬ��п����Ӧ�죩���������ɣ�
��5����ʼ����Ϊ������Ĥ������п�ı��棬Ȼ����죬���ŷ�Ӧ�Ľ������������������С����Ӧ�����ֱ��������������ɣ�
��6���¶�
��7��0.2�� 93.3% ���ϸ�
��������
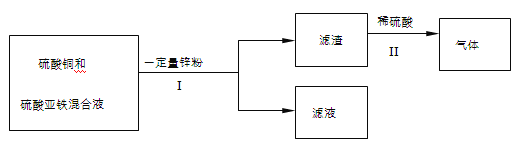
�����������1��п��ϡ���ᷴӦ���ɵ�������п��������Zn+H2SO4==ZnSO4+H2����
��2��ͼװ���ռ��ռ������ķ����Dz��õ���ˮ���ռ�����Ͳ����������ȡ�ų�ˮ��������ų�ˮ�������Ϊ�����������ˮֻ�ܴ�e���ų�����������f��ͨ�룻
��3��Ҫ�Ƚϲ�ͬ��������������Է�Ӧ������Ӱ�죬Ҫ���ÿ��Ʊ�������̽���������������������ͬ������������ȫ��ͬ��ʵ����жԱȣ���ѡ���٢����ڢ���
��4��ͨ���Ա�ʵ���֪����ԽŨ����ӦԽ�죻�����Ŀ���ԽС����Ӧ����Խ�죻
��5�����ݲ��ϣ��ڳ����µĿ����У�п�ı�������һ�㡰����Ĥ������ʼ����Ϊ������Ĥ������п�ı��棬Ȼ����죬���ŷ�Ӧ�Ľ������������������С����Ӧ�����ֱ�����
��6��п�����ᷴӦ�Ŀ������ܻ����¶ȵ�Ӱ�죬һ����˵�����ʵ�Խ�ߣ���Ӧ����Խ�죻
��7�����������غ㶨�ɻ�ѧ��Ӧǰ�����ʵ����������䣬��ô���ٵ�������Ϊ���ɵ�������������
����������=6g+100g-105.8g=0.2g
���û�ѧ����ʽ���������������ȼ��ɼ��������������������
����������Ϊx��
Fe+H2SO4==FeSO4+H2��
56 2
X 0.2g
56��x =2��0.2g
X=5.6g
������Ʒ��������������=5.6g��6g ��100%=93.3%
�����еĺ�̼����2%-4.3%����������Ҫ����95.7%�����ó��������������ϸ�