题目内容
【题目】海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 (填一种即可);
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。

上述过程中,试剂A可由生石灰和水反应得到,此反应为反应 (填“放热”或“吸热”) ;可通过 (填操作名称)得到沉淀B。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
【答案】(1)蒸馏或膜分离技术;(2)蒸发结晶(3)放热 ;过滤;海水中含有很多杂质,得到的氯化镁溶液的浓度低。
【解析】
试题分析:(1)从海水中获取淡水,可以采用蒸馏、膜分离技术等;(2)粗盐的主要成分是氯化钠,氯化钠的溶解度受温度影响变化不大,从海水中得到粗盐可以采用蒸发结晶的方法;(3)生石灰与水反应,生成氢氧化钙,放出大量的热,将沉淀与溶液分离,可用过滤的方法;海水中含有好多杂质,得到的氯化镁不纯净,浓度低,而通过步骤①、②得到的MgCl2溶液浓度较高。

【题目】(12分)小明同学对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】
a.可能与硫酸的质量分数有关;
b.可能与锌的形状有关。
【查阅资料】
锌的化学性质比较活泼,在常温下的空气中,表面生成一层“保护膜”,可阻止进一步氧化。该“保护膜”可以和酸反应,但不产生氢气。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 20% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式______________________________。
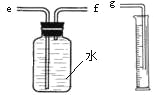
(2)小兵用图装置收集并测量氢气的体积,其中量筒的作用是_______________________,
氢气应从________(填e或f或g)管通入;
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________;
【得出结论】
(4)结论是_____________________________________________________;
【评价与反思】
(5)下表是小兵第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11. 9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的先慢后快最后又变慢的原因___________________________;
(6)你认为锌与硫酸反应的快慢可能还受 因素影响?
(7)取某厂生产的生铁样品6g,与100g足量的稀硫酸充分反应后,称得剩余物质的总质量为105.8g。
①生成气体的质量为 克;
②该厂生产的生铁样品中铁的质量分数是多少?(写出具体的过程,结果精确到0.1%)
③该厂生产的生铁是否合格? (填“合格”或“不合格”)