题目内容
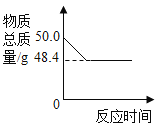
【题目】实验室用48.0g过氧化氢溶液和2.0g二氧化锰制取氧气,实验的相关数据如图所示。
(1)反应中二氧化锰的作用是_____。
(2)反应生成氧气的质量为_____g。
(3)计算参加反应的过氧化氢的质量。(写出必要的计算过程)_____________________
【答案】反应中二氧化锰的作用是 加快过氧化氢的分解 反应生成氧气的质量为 1.6g 参加反应的过氧化氢的质量为3.4g
【解析】
反应中二氧化锰做催化剂,其催化作用,更具体的说是加快过氧化氢的分解,所以建议填写:加快过氧化氢的分解。根据质量守恒定律可得,生成的氧气的质量为50.0g﹣48.4g=1.6g
设参加反应的过氧化氢的质量为x
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
![]() =
=![]() x=3.4g
x=3.4g
故答案为:(1)反应中二氧化锰的作用是 加快过氧化氢的分解。(2)反应生成氧气的质量为 1.6g。(3)参加反应的过氧化氢的质量为3.4g。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目