题目内容
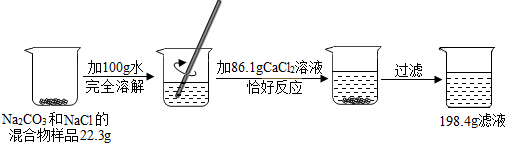
请根据如图所示的实验过程和提供的数据(假设过氧化氢和水不挥发),计算:
(1)最后得到的固体的质量为
(2)过氧化氢溶液中过氧化氢的质量分数.
资料:
①过氧化氢溶液是过氧化氢与水的混合物.
②过氧化氢溶液中过氧化氢的质量分数:H2O2%=
×100%.

(1)最后得到的固体的质量为
5
5
g.(2)过氧化氢溶液中过氧化氢的质量分数.
资料:
①过氧化氢溶液是过氧化氢与水的混合物.
②过氧化氢溶液中过氧化氢的质量分数:H2O2%=
| 过氧化氢的质量 | 过氧化氢溶液的总质量 |
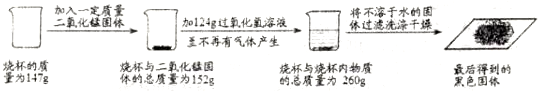
分析:(1)依据加入二氧化锰后烧杯质量的变化可知加入的二氧化锰的质量;
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因此完全反应后,物质减少的质量就是生成的气体质量;
根据过氧化氢分解的化学方程式和(1)中计算出的氧气的质量,就可计算出参与反应的过氧化氢的质量,然后根据质量分数公式计算即可.
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因此完全反应后,物质减少的质量就是生成的气体质量;
根据过氧化氢分解的化学方程式和(1)中计算出的氧气的质量,就可计算出参与反应的过氧化氢的质量,然后根据质量分数公式计算即可.
解答:解:(1)分析反应的过程可知最后剩余的黑色固体是二氧化锰,二氧化锰是该反应的催化剂,所以反应前后质量不变,质量为152g-147g=5g;
(2)反应中生成氧气的质量为:152g+124g-260g=16g;
设解:设124 g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2
2H2O+O2↑
68 32
x 16g
=
x=34g
过氧化氢的质量分数为:
×100%=27.4%,
(1)5(2)答:过氧化氢溶液中过氧化氢的质量分数为27.4%
(2)反应中生成氧气的质量为:152g+124g-260g=16g;
设解:设124 g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2
| ||
68 32
x 16g
| 68 |
| 32 |
| x |
| 16g |
x=34g
过氧化氢的质量分数为:
| 34g |
| 124g |
(1)5(2)答:过氧化氢溶液中过氧化氢的质量分数为27.4%
点评:解此题的关键是根据图示测得的相关数据及质量守恒定律计算出隐藏的已知量---生成的氧气质量;进而按化学方程式的解题格式解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 .
.