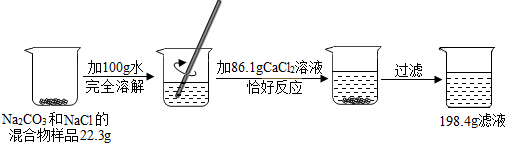
题目内容
请根据如图所示的实验过程和提供的数据,解答下列问题:

(1)实验过程中,产生沉淀的质量为
(2)最终所得溶液的溶质质量分数为多少?(写出计算过程)
(3)原固体混合物中钠元素的质量为

(1)实验过程中,产生沉淀的质量为
5.8
5.8
g.(2)最终所得溶液的溶质质量分数为多少?(写出计算过程)
(3)原固体混合物中钠元素的质量为
5.06
5.06
g.分析:(1)根据氢氧化钠和硫酸钠的固体混合物的质量和水的质量再加上100g硫酸镁的质量为205.8g,减去滤液的质量就为沉淀的质量.
(2)根据氢氧化钠和硫酸镁反应的化学方程式计算出硫酸钠的质量,再加上原来的固体中的硫酸钠的质量然后除以溶液的质量即可求出.
(3)根据质量守恒定律,求出反应后溶液中硫酸钠中钠元素的质量即是原固体混合物中钠元素的质量.
(2)根据氢氧化钠和硫酸镁反应的化学方程式计算出硫酸钠的质量,再加上原来的固体中的硫酸钠的质量然后除以溶液的质量即可求出.
(3)根据质量守恒定律,求出反应后溶液中硫酸钠中钠元素的质量即是原固体混合物中钠元素的质量.
解答:解:(1)产生沉淀的质量为96.38g+9.42g+100g-200g=5.8g
(2)设所得溶液中溶质硫酸钠的质量为x,原固体中氢氧化钠的质量为y
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
80 142 58
y x 5.8g
=
y=8g
=
x=14.2g
所得溶液中溶质硫酸钠的质量为9.42g-8g+14.2g=15.62g
所得溶液溶质质量分数为
×100%=7.81%
答:所得溶液溶质质量分数为7.81%.
(3)钠元素都转化到硫酸钠中,硫酸钠中钠元素的质量为15.62g×
=5.06g
(2)设所得溶液中溶质硫酸钠的质量为x,原固体中氢氧化钠的质量为y
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
80 142 58
y x 5.8g
| 80 |
| y |
| 58 |
| 5.8g |
y=8g
| 142 |
| x |
| 58 |
| 5.8g |
x=14.2g
所得溶液中溶质硫酸钠的质量为9.42g-8g+14.2g=15.62g
所得溶液溶质质量分数为
| 15.62g |
| 200g |
答:所得溶液溶质质量分数为7.81%.
(3)钠元素都转化到硫酸钠中,硫酸钠中钠元素的质量为15.62g×
| 46 |
| 142 |
点评:本题主要考查根据化学方程式的计算,要注意所得溶液中溶质的质量有生成的还有原来的.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 .
.