题目内容
(2012?红桥区一模)请根据如图所示的实验过程和提供的数据,求所得溶液中溶质的质量分数(结果保留到0.1%).
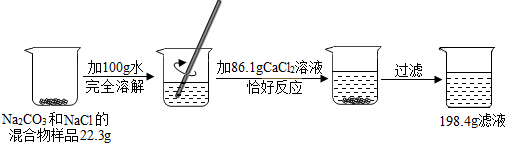

分析:根据质量守恒定律可以知道,溶液减少的质量即为生成的碳酸钙的质量;根据碳酸钠和氯化钙反应的化学方程式,已知碳酸钙的质量可以求出生成的氯化钠和反应的碳酸钠的质量,从而完成该题的解答;
解答:解:碳酸钙的质量=22.3g+100g+86.1g-198.4g=10g;
设纯碱样品中碳酸钠的质量为x,生成NaCl的质量为y
Na2CO3+CaCl2═2NaCl+CaCO3↓
106 117 100
x y 10g
=
x=10.6g
=
y=11.7g
原有NaCl质量=22.3g-10.6g=11.7g
总共NaCl质量=11.7g+11.7g=23.4g
反应后所得溶液的溶质质量分数
×100%=11.8%
答:反应后所得溶液的溶质质量分数为11.8%
设纯碱样品中碳酸钠的质量为x,生成NaCl的质量为y
Na2CO3+CaCl2═2NaCl+CaCO3↓
106 117 100
x y 10g
| 106 |
| x |
| 100 |
| 10g |
x=10.6g
| 117 |
| y |
| 100 |
| 10g |
y=11.7g
原有NaCl质量=22.3g-10.6g=11.7g
总共NaCl质量=11.7g+11.7g=23.4g
反应后所得溶液的溶质质量分数
| 23.4g |
| 198.4g |
答:反应后所得溶液的溶质质量分数为11.8%
点评:本题中考查的知识点较多,主要是依据化学方程式进行计算,在解答时要注意运用质量守恒定律来得出计算所必须的已知量,然后依据化学方程式进行计算,

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
(2012?红桥区一模)下面除出混合物中少量杂质(括号内为杂质)的方案中,不合理的是( )
|