题目内容
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
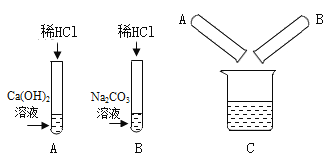
(1)B试管中的实验现象为_________,A试管中反应的化学方程式为___________;
(2)将反应后AB试管中废液倒入一个洁净的烧杯中如图C所示,观察到烧杯中先有气泡产生,后有白色沉淀出现,将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(做出猜想)猜想一:NaCl;猜想二:NaCl和CaCl2;猜想三:________。
(设计实验)请完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加碳酸钠溶液 | _________ | 猜想二不成立 |
②取少量滤液于试管中,滴加__________(填名称) | _________ | 猜想三成立 |
【答案】产生气泡 Ca(OH)2 + 2HCl =CaCl2 + 2H2O NaCl 、Na2CO3 无现象 稀盐酸 产生气泡
【解析】
(1)B试管中稀盐酸和碳酸钠反应生成二氧化碳气体,实验现象为产生气泡,A试管中稀盐酸和氢氧化钙溶液反应生成氯化钙和水,反应的化学方程式为:Ca(OH)2 + 2HCl =CaCl2 + 2H2O。故填:产生气泡;Ca(OH)2 + 2HCl =CaCl2 + 2H2O;
(2)[作出猜想] 观察到烧杯中先有气泡产生,后有白色沉淀出现,说明A中盐酸过量,B中碳酸钠过量,混合后盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,盐酸完全反应后碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
猜想一:氯化钙和碳酸钠前后完全反应时溶质是NaCl;
猜想二:氯化钙过量时溶质是NaCl和CaCl2;
猜想三:碳酸钠过量时溶质是NaCl和Na2CO3;
故填:NaCl 、Na2CO3;
[设计实验]
①取少量滤液于试管中,滴加碳酸钠溶液,无明显现象,说明滤液中不含有氯化钙;
②取少量滤液于试管中,滴加稀盐酸,产生气泡,是因为盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,说明溶液中含有碳酸钠,实验过程如下所示:
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
②取少量滤液于试管中,滴加稀盐酸 | 产生气泡 | 猜想三成立 |
故填:无现象;稀盐酸;产生气泡。

【题目】化学与生活密切联系,生活中处处有化学。请你根据所学化学知识回答下列问题。
(1)社会实践活动小组的同学到敬老院给李奶奶送去鲜花和生日蛋糕,花香满堂,请你用微粒的观点解释闻到花香的原因____;点燃生日蜡烛祝愿后,大家一起将蜡烛吹灭,这种熄灭蜡烛火焰的原理是______。
(2)天然水中含有许多杂质。自来水生产过程中,常用到活性炭,利用其____作用;杀菌消毒时,会用到某种消毒泡腾片,其中有效成分为二氧化氯,氯元素的化合价为___。
(3)家庭厨房就是一个化学小世界,“锅硫瓢盆”和“柴米油盐”中包含着许多的化学知识。
①下列厨房用品的主要材料,属于有机合成材料的是_____(填写代号,下同)。

②均衡膳食,有利于人体健康.小强家某天午饭的食谱如下表:
主食 | 馒头 |
副食 | 红烧排骨、花生米、清蒸鱼 |
饮料 | 牛奶 |
从营养学的角度考虑,你建议食谱中应增加___(填写代号)
A 油饼 B 烧豆腐 C 凉拌黄瓜 D 炒鸡蛋
【题目】石灰石是重要的矿石之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)哪几次反应中矿石中碳酸钙有剩余:________
(2)上表中m的数值是________
(3)试计算出这种石灰石矿中碳酸钙的质量分数________