题目内容
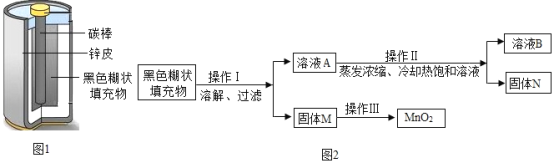
【题目】小明取酸性锌锰干电池进行探究,他发现电池内部结构如图1所示。
(查阅资料)
①锌皮中含有少量的铁
②黑色糊状填充物由炭黑、MnO2、ZnC12和NH4Cl等组成
③有关数据见下表
温度/p | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4C1 | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnC12 | 343 | 395 | 452 | 488 | 541 | 614 | |
(实验探究一)小明取适量黑色糊状填充物,按图2所示实验流程进行探究。
(1)溶液A中溶质主要有_____________(填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是 ___________。
(2)欲从固体M中得到较纯的MnO2,操作Ⅲ可采用的简便方法是_____。
(实验探究二)小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2 生成。实验中可观察到的现象是____________。
(2)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液 E 和固体F。当溶液E中只含一种溶质时,该溶质是_____(填化学式);当固体F中只含一种物质时,溶液E中最少含有________种溶质。
(3)若将6.5g锌皮与足量稀硫酸完全反应,则生成氢气的质量__0.2g(选填“<”、“>”或“=”)。
【答案】ZnCl2和NH4Cl 氯化锌的溶解度受温度影响变化大(或二者的溶解度随温度变化不同) 灼烧 锌的表面有气泡产生 ZnSO4 二 >
【解析】
[实验探究一]
(1)黑色糊状填充物由炭黑、MnO2、ZnC12和NH4Cl组成,把糊状物加水,ZnC12和NH4Cl能溶于水,炭黑、MnO2不溶于水,过滤,溶液A中的溶质主要是能溶于水的ZnC12和NH4Cl,把溶液A蒸发、冷却,利用氯化锌的溶解度受温度影响变化大(或二者的溶解度随温度变化不同);
故填:ZnC12和NH4Cl;氯化锌的溶解度受温度影响变化大(或二者的溶解度随温度变化不同)。
(2)固体M中主要有炭黑、MnO2,炭黑能燃烧,MnO2不能燃烧,可采取高温灼烧的方法除去炭黑;
故填:灼烧。
[实验探究二]
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,锌和稀盐酸反应生成氯化锌和氢气,可观察到的现象是锌的表面有气泡产生;
故填:锌的表面有气泡产生。
(2)把锌放入一定量CuSO4溶液中,锌与硫酸铜反应生成铜和硫酸锌,充分反应后,溶液中只含一种溶质,硫酸铜溶液中的硫酸铜全部反应,溶液中有的溶质是反应生成的硫酸锌;当固体F中只含一种物质时,即只含有铜时,锌和硫酸铜反应生成了硫酸锌和铜,铁和硫酸铜反应生成了硫酸亚铁和铜,因此溶液E中最少含有硫酸锌和硫酸亚铁2种溶质。
故填:ZnSO4;二。
(3)设6.5g锌与足量稀硫酸反应,生成氢气的质量为x
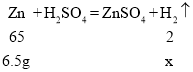
![]()
x=0.2g
设6.5g铁与足量稀硫酸反应,生成氢气的质量为y
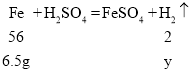
![]()
y=0.23g
由以上计算可知,若将6.5g锌皮与足量稀硫酸完全反应,生成氢气的质量大于0.2g;
故填:>。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】测定合金中铜的质量分数。为测定某铜、锌合金中铜的质量分数,兴趣小组同学称取20g合金于烧杯中,将80g稀盐酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)该铜、锌合金中铜的质量分数为_____________? (写出计算过程)
(2)第三次加入稀盐酸后烧杯内溶液中的溶质为________________(写化学式)。
【题目】化学兴趣小组为验证质量守恒定律,做镁条在空气中燃烧的实验(如图1)。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。

(1)镁条燃烧的化学方程式是_____;
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。小马认为这个反应不遵循质量守恒定律。你_____(“同意”或“不同意”)他的观点。你认为出现这样实验结果的原因可能是_____。
(3)小红按如图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)
固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2
(实验探究)请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
将收集到的黄色固体放入试管中,加入适量的_____,在试管口放置湿润红色石蕊试纸。 | ①_____; ②_____。 | 黄色固体是Mg3N2 |
(反思与交流)空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是_____。