题目内容
【题目】测定合金中铜的质量分数。为测定某铜、锌合金中铜的质量分数,兴趣小组同学称取20g合金于烧杯中,将80g稀盐酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)该铜、锌合金中铜的质量分数为_____________? (写出计算过程)
(2)第三次加入稀盐酸后烧杯内溶液中的溶质为________________(写化学式)。
【答案】67.5% HCl、ZnCl2
【解析】
解:(1)有表格信息可知,20g合金与足量的稀盐酸反应产出氢气质量为20g+20g+20g+20g+20g-99.80g=0.2g
设:合金中锌的质量为x。
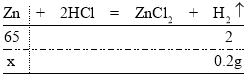
![]() x=6.5g
x=6.5g
则该铜、锌合金中铜的质量分数为=![]()
(2)第一次加入20g稀盐酸产生氢气质量为20g+20g-39.92g=0.08g;
第二次加入20g稀盐酸产生氢气质量为39.92g+20g-59.84g=0.08g;
第三次加入20g稀盐酸产生氢气质量为59.84g+20g-79.80g=0.04g;
则第三次加入的盐酸过量;
第三次加入稀盐酸后烧杯内溶液中的溶质为:ZnCl2和HCl。

【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
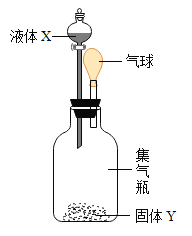
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
A.①②③④⑤B.①②④C.①③④D.①④⑤
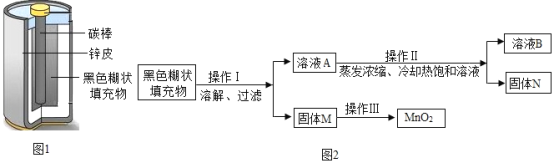
【题目】小明取酸性锌锰干电池进行探究,他发现电池内部结构如图1所示。
(查阅资料)
①锌皮中含有少量的铁
②黑色糊状填充物由炭黑、MnO2、ZnC12和NH4Cl等组成
③有关数据见下表
温度/p | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4C1 | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnC12 | 343 | 395 | 452 | 488 | 541 | 614 | |
(实验探究一)小明取适量黑色糊状填充物,按图2所示实验流程进行探究。
(1)溶液A中溶质主要有_____________(填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是 ___________。
(2)欲从固体M中得到较纯的MnO2,操作Ⅲ可采用的简便方法是_____。
(实验探究二)小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2 生成。实验中可观察到的现象是____________。
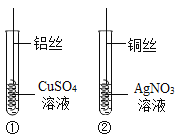
(2)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液 E 和固体F。当溶液E中只含一种溶质时,该溶质是_____(填化学式);当固体F中只含一种物质时,溶液E中最少含有________种溶质。
(3)若将6.5g锌皮与足量稀硫酸完全反应,则生成氢气的质量__0.2g(选填“<”、“>”或“=”)。
【题目】(2011年浙江宁波,19题、)将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X。测得反应前后物质的质量如下表:
物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 6.6 | 2.7 | m |
下列判断正确的是 ( )
A.表中m的值为13.5 B.该反应属于分解反应
C.物质X能在氧气中燃烧 D.物质X中一定含有氢元素