题目内容
【题目】化学是以实验为基础的科学。
(1)关于下列实验操作的叙述,正确的是_____。
A把氢氧化钠固体放在天平的纸片上称量
B用剩的药品一定要放回原瓶
C蒸发溶液时用玻璃棒搅拌主要是为了加快蒸发
D配制稀硫酸时,要把浓硫酸慢慢倒入水中
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图1所示。
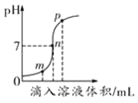
图1
①根据图示判断,该实验是将_____(填“氢氧化钠溶液”或“盐酸”)滴加到另一种溶液中。
②取m点时的溶液在蒸发皿中蒸干,得到物质为_____。
③在测定p点溶液的pH时,若用用水润试过的pH试纸测量,会使测量结果_____(填“偏大”、“偏小”或“不受影响”)
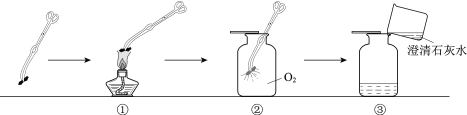
(3)如图2是实验室常用的气体制取装置,请回答:
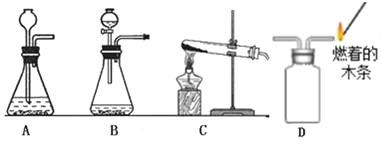
图2
①写出用C装置制取氧气的化学方程式________________。
②与A装置相比,B装置有什么优点__________________?
③可用D装置采用“排空气法”收集并验满二氧化碳,请在图中将导管补画完整_____________。
(4)实验室称取7g含杂质的锌放入烧杯中,向其中加入100g一定质量分数的稀硫酸(杂质不参与反应),恰好完全反应。反应后,称量烧杯中剩余物质总质量为106.8g,则稀硫酸中溶质质量分数是多少_____?
【答案】D 氢氧化钠溶液 NaCl(氯化钠) 偏小  控制化学反应速率等
控制化学反应速率等  9.8%
9.8%
【解析】
(1)A.由于氢氧化钠具有腐蚀性,所以应该把氢氧化钠固体放在天平的烧杯或者表面皿而非纸片上称量。错误;
B.用剩的药品一定要放回原瓶,会导致原瓶药品被污染。错误;
C.蒸发溶液时用玻璃棒搅拌主要是为了防止液体飞溅,而非主要是为了加快蒸发。错误;
D.配制稀硫酸时,要把浓硫酸慢慢倒入水中,防止硫酸溶解放热导致的液体飞溅。正确;
故选:D。
(2)①由于开始pH小于7,即烧杯中为盐酸。所以该实验是将氢氧化钠溶液滴加到另一种溶液中。
②取m点时的溶液为氢氧化钠的量不足,此时的溶质为生成的氯化钠和剩余的HCl,由于HCl易挥发,所以在蒸发皿中蒸干,得到物质为 NaCl(氯化钠)。
③在测定p点溶液的pH时,若用用水润试过的pH试纸测量,相当于稀释了溶液,而p点溶液为碱性,所以会使测量结果偏小。
(3)①用C装置制取氧气,是固体加热制取气体,且试管口没有棉花团,所以是氯酸钾在二氧化锰的催化下受热分解为氯化钾和氧气,对应的化学方程式为 。
。
②与A装置相比,由于B多了一个开关,所以B装置的优点为:可以控制化学反应速率,同时由于气体不能从分液漏斗下端逸出,所以液体药品不需要淹没漏斗下端,所以节约药品等。
③可用D装置采用“排空气法”收集并验满二氧化碳,由于二氧化碳的密度大于空气,所以长进短出,在图中将导管补画完整为:
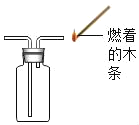
(4)根据质量守恒定律可得,生成氢气的质量为7g+100g﹣106.8g=0.2g
设稀硫酸中溶质质量分数为x

![]() x=9.8%
x=9.8%
稀硫酸中溶质质量分数是9.8%。