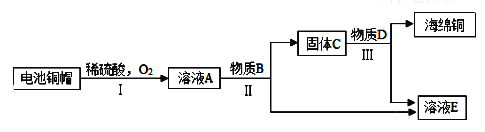
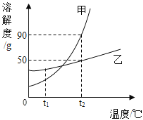
题目内容
【题目】某科学兴趣小组的同学设计了如下四个实验装置(天平略)来验证质量守恒定律。
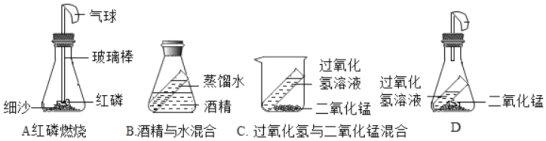
(1)上述的四个实验装置中_____装置能直接用于验证质量守恒定律;
(2)①装置A中发生反应的化学符号表达式:_____,实验过程中气球的变化是_____。
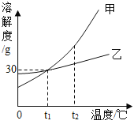
②点燃红磷的实验过程中,固体质量变化如图1所示:参加反应的氧气质量为_____g.
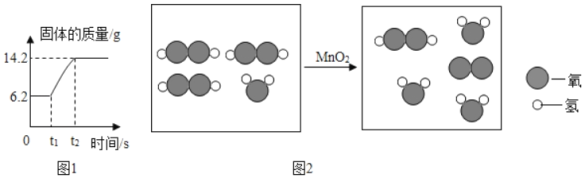
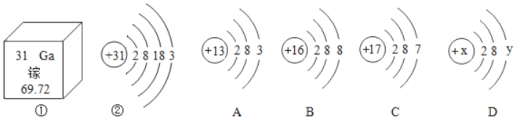
(3)C、D反应的微观示意图如图2所示,实际生成的物质分子数目之比为_____。
【答案】A、D 4P+5O2![]() 2P2O5 先变大后变瘪 8 2:1
2P2O5 先变大后变瘪 8 2:1
【解析】
(1)上述的四个实验装置,只有AD两个装置能直接用于验证质量守恒定律,另外两个装置被否定的原因分别是B装置内发生的变化属于物理变化,不能用质量守恒定律解释,C装置内产生的氧气会逸散到空气中,因此不能用来验证质量守恒定律。故填:A、D;
(2)①装置A为红磷燃烧生成五氧化二磷,发生反应的化学符号表达式4P+5O2![]() 2P2O5;实验过程中气球的变化是先变大后变瘪;
2P2O5;实验过程中气球的变化是先变大后变瘪;
②从图示看出,6.2g表示反应前固体的质量,就是红磷的质量,14.2g表示反应后固体的质量,是五氧化二磷的质量,则14.2g﹣6.2g=8g就表示参加反应的氧气的质量;
(3)过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为2H2O2![]() 2H2O+O2↑;可知实际生成的物质分子数目之比为2:1。
2H2O+O2↑;可知实际生成的物质分子数目之比为2:1。

【题目】碳酸钠广泛用于造纸、纺织、制革等工业,是一种重要的化工原料。我国侯德榜发明了将制碱与制氨结合起来的联合制碱法,为碳酸钠的工业化生产作出了巨大贡献。
(查阅资料)侯氏制碱法中主要反应:
Ⅰ.NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
Ⅱ.2NaHCO3=Na2CO3+H2O+CO2↑
(实验探究)小明以粗盐配制饱和食盐水,并采用如图1所示装置模拟制备碳酸氢钠,进而制得碳酸钠。
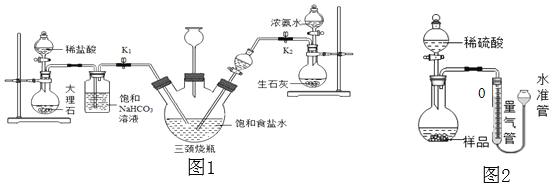
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。请回答下列问题:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,写出对应的化学方程式______,再过滤,然后向滤液中加入适量______,得到氯化钠溶液。
(2)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为______。
(3)三颈烧瓶上连接的长颈漏斗的主要作用是______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是______。
(4)根据实验记录,计算t2时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_____。
(拓展延伸)小华设计如图2的实验装置测定某纯碱样品(含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀硫酸反应,通过排饱和碳酸氢钠溶液测定生成CO2的体积,计算样品中碳酸钠的质量分数。(已知常温常压下CO2的密度是1.977g/L)
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是______(填字母)。
A.500mLB.1000mLC.1500mLD.2000mL
(2)若实验中测得碳酸钠质量分数偏小,下列可能的原因是______。
a.装置漏气
b.读取数据时量气管的液面低于水准管的液面
c.反应结束后烧瓶中有CO2残留
d.读取数据时仰视读数
e.稀硫酸加入烧瓶占据体积