题目内容
【题目】有 A、B、C 三种原子,已知 A 原子的核外第二层电子数等于第一层和第三层电子数之 和;B 原子的最外层电子数比次外层电子数多 4 个;C 原子的核电荷数比 A 原子的阴离子的核外电子数少6个。则:
(1)A原子的结构示意图为__________。
(2)B离子的结构示意图为__________。
(3)C原子的名称为__________。
【答案】![]()
![]() 镁原子
镁原子
【解析】
A、B、C 三种原子,已知A原子的核外第二层电子数等于第一层和第三层电子数之和,由于第一层有2个电子,第二层有8个电子,所以第三层应有电子数=8﹣2=6,所以该原子的电子数=2+8+6=16,为硫原子,硫原子在化学反应中易得到2个电子形成稳定结构;B原子的最外层电子数比次外层电子数多4个,由于最外层电子数不超过8,所以该原子的次外层应是第一层,电子数是2,最外层有6个电子,所以该原子的电子数=6+2=8,在原子中,质子数=核外电子数= 8,为氧原子,氧原子在化学反应中易得到2个电子形成稳定结构;C 原子的核电荷数比A原子的阴离子(电子数为18)的核外电子数少 6个,所以C是镁原子,经过验证,推导正确,因此:
(1)A原子的结构示意图为 ![]() ;
;
(2)B离子的结构示意图为 ![]() ;
;
(3)C原子的名称为镁原子。

 阅读快车系列答案
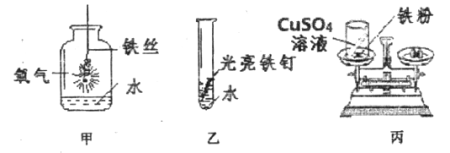
阅读快车系列答案【题目】如图是测定空气中氧气含量的两套实验装置,请据图回答下列问题(提示:铜粉在加热条件下会与氧气反应生成黑色氧化铜固体):
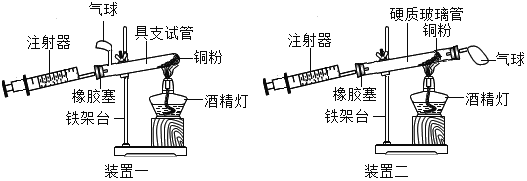
(1)装置一和装置二中气球的位置不同,_____(填“装置一”或“装置二”)更合理,理由是_____.
(2)根据实验测得的相关数据(见下表),计算空气中氧气的体积分数.
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 7mL | _____ |