题目内容
【题目】有一含有纯碱的食盐样品,为了测定其中碳酸钠的含量,某同学称取10g的样品放入烧杯中,向烧杯中加入100g足量的 稀盐酸,充分反应后气体全部逸出,烧杯中剩余物的总质量为109.56g(假设产生的气体全部逸出。以下计算结果保留一位小数)
(1)样品中碳酸钠的含量是___
(2)NaCl中氯元素质量分数是____
(3)反应后溶液中溶质质量分数是___?
【答案】10.6% 60.7% 9.2%
【解析】
(1)根据质量守恒定律,可得出生成的二氧化碳的质量为:10g+100g-109.56g=0.44g;
设30g样品中碳酸钠的质量为x,生成NaCl的质量为y。
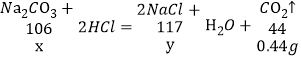
![]()
解得:x=1.06g,y=1.17g,
样品中碳酸钠的质量分数是![]() ×100%=10.6%。
×100%=10.6%。
(2)NaCl中氯元素质量分数是![]() ≈60.7%。
≈60.7%。
(3)所得溶液中NaCl的质量为原样品中氯化钠的质量与生成氯化钠的质量之和,
氯化钠的质量=1.17g +(10g-1.06g)=10.11g,
反应后溶液中溶质质量分数=![]() ×100%≈9.2%。
×100%≈9.2%。
答:反应后所得溶液中溶质的质量分数9.2%。

练习册系列答案
相关题目