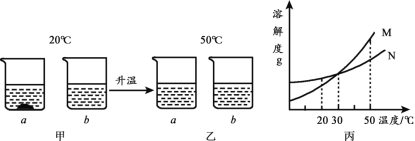
题目内容
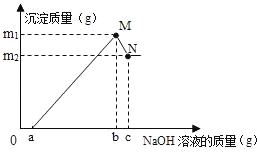
【题目】小明对废弃的易拉罐很有兴趣,为测定易拉罐中铝元素的质量分数,他剪取W克镁铝合金的易拉罐,先用过量稀硫酸溶解,然后再向溶液中滴加一定量的NaOH溶液得到Al(OH)3沉淀,继续滴加NaOH溶液时Al(OH)3被溶解[已知:Al(OH)3与NaOH反应成NaAlO2和H2O].而Mg(OH)2不溶于NaOH溶液,沉淀质量与滴加NaOH溶液质量关系如图所示
(1)写出Al(OH)3与NaOH反应的化学方程式_____;
(2)在a点时,溶液中的溶质有哪些?_____(填化学式);
(3)易拉罐中铝元素的质量分数为多少?_____(用字母表示,假定易拉罐只由镁和铝组成)
【答案】Al(OH)3+NaOH=NaAlO2+2H2O MgSO4、Al2(SO4)3、Na2SO4 (100﹣![]() )%
)%
【解析】
镁、铝与稀硫酸反应生成硫酸镁、硫酸铝,合金全部溶解,向所得溶液中滴加 NaOH溶液,与过量的硫酸反应生成硫酸钠,此时溶液为硫酸镁、硫酸钠、硫酸铝的混合物,继续加入氢氧化钠到增大沉淀量,金属镁离子铝离子沉淀完全,再继续加入氢氧化钠至氢氧化铝全部溶解,再加入氢氧化钠沉淀量不变。
(1)Al(OH)3与NaOH反应成NaAlO2和H2O,化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O;
(2)在a点时,NaOH溶液恰好与过量稀硫酸反应,故此时溶液中的溶质除硫酸镁和硫酸铝外还有NaOH与稀硫酸反应生成的硫酸钠;
(3)有图象可知生成氢氧化镁的质量为m2,
镁元素的质量:m2×![]() ×100%=
×100%=![]() m2
m2
故易拉罐中铝元素的质量分数:![]() =(100﹣
=(100﹣![]() )%。
)%。

【题目】煅烧石灰石(主要成分 CaCO3)生成生石灰(CaO)和二氧化碳。为了测定某石灰石中碳酸钙(CaCO3)的含量,现称取 24.0g 石灰石样品,进行四次高温煅烧、冷却,称量剩余固体的质量 (杂质不参加反应),记录实验数据如下:
操作 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量 | 21.6g | 19.2g | 15.2g | 15.2g |
试计算:
(1)完全反应后生成二氧化碳的质量为_____;
(2)求该石灰石样品中碳酸钙的质量_____。